
A mes parents, Nicole et Giam,
pour l’Amour et le Soutien qu’ils
m’ont offert durant toutes ces années...

« Dans une vie qui serait pleine de déceptions si ce n’était déjà une joie de passer des heures tranquilles dans le paysage et de voir, en espérant une loutre ou un chat sauvage, un merle d’eau ou un mulot, il (le blaireau) est la certitude et la consolation. Quel bonheur, lorsque le soleil décline et qu’on est rassasié de travail, de lever les yeux de l’ouvrage minutieux, de poser ses outils, d’enfour-cher son vélo. Puis de dévaler dans les feuilles mortes, s’asseoir sur la terre humide, la joue et l’épaule contre un tronc. Confondu dans la nature, on laisse son âme se répandre dans le bois, en une détente des sens pleine de vigilance, en attendant que la forêt s’incarne en un être velu, soufflant et circonspect. Toutes les fibres de mon corps accompagneront ses mouvements, tandis que je resterai immobile comme la souche avec laquelle je me confonds. Les feuilles sèches se déplient à petits coups dans l’humidité du soir, les fourmis semblent faire beaucoup de bruit. Les merles, à leur coucher, s’agitent, égrènent leurs cris précipités. La hulotte pousse quelques sons stridents, une clameur étouffée. Une tête rayée apparaît dans la pénombre du terrier, flaire tout autour de l’ouverture, hésite, avance, recule, disparaît, reparaît. Le blaireau enfin se coule dehors avec précaution. Souvent, il s’assied, gratte, de sa patte de derrière, son poil rude qui bruisse comme du foin. Parfois il se renverse sur le dos et, accoudé, pétrit et gratte sa large panse, grassement étalée. »
Dessin et texte extraits du livre
Les Mammifères sauvages d’Europe de Robert Hainard (Tome I, 1987)
Inhaltsverzeichnis
Inhaltsverzeichnis 2
1. EINLEITUNG 4
1.1. Stand des Wissens 5
1.2. Ziel der Arbeit 6
1.3. Fragestellungen 7
2. Material und Methoden 8
2.1. Untersuchungsgebiet 9
2.2. Kartierung 9
2.3. Nachtbeobachtungen 12
2.4. Erfassung der Habitatparameter 12
2.5. Statistische Auswertungen 15
3. Resultate 16
3.1. Habitatwahl 17
Anzahl, Dichte und Verteilung der Baue 17
Standortscharakteristika 17
Anzahl, Dichte, Verteilung und Merkmale der Latrinen 25
3.2. Nahrungsangebot 26
Kartierung und Charakterisierung der Kulturlandschaft 26
Zeitliche Variation der Gesamtfläche der Aecker-, Wiesen- und
Weide-Typen und ihrer räumlichen Verteilung 26
Ressourcen-Angebot um die Baue 33
Zeitliche Verfügbarkeit der verschiedenen Getreide-Arten 35
Räumliches und zeitliches Obstangebot 36
3.3. Sozialorganisation 38
4. Diskussion 39
4.1. Habitatwahl 40
Probleme bei der Bestimmung der Baue und Latrinen 40
Anzahl, Verteilung und Dichte der Baue 41
Baumerkmale 42
Rolle der verschiedenen Habitatparameter 43
Wieso wurden so wenig Latrinen gefunden ? 47
4.2. Nahrungsangebot 48
Räumliche und zeitliche Verteilung der Wiesen und Weiden 48
Räumliche und zeitliche Verfügbarkeit der Getreide-Arten 48
Räumliches und zeitliches Obstangebot 49
4.3. Sozialorganisation 49
4.4. Bilanz : Passen unsere Beobachtungen zu dem vorgeschlagenen Modell ? 50
5. Zusammenfassung / RÉsumÉ / SUMMARY 52
Danksagung 56
Literatur 58
Anhang 1 : Hypothèse du Seuil Energétique Critique (HSEC) 65
Mise au point 66
Introduction 67
Aperçu des connaissances actuelles 69
Organisation spatiale, territorialité et socialité 69
Discussions sur la vie de groupe 70
Hypothèses sur la formation des groupes 70
Construction de la HSEC 76
Quelles explications la HSEC aimerait-elle apporter ? 76
Hypothèse de départ 76
Facteurs alimentaires qui influencent la formation des groupes 77
Comment la dimension et l’allure du domaine vital ou du
territoire sont-elles choisies ? 77
Les deux phases explicatives de la HSEC : habitat optimal et suboptimal 78
Formulation de la HSEC dans un habitat optimal 81
Prévisions de la HSEC pour un habitat suboptimal 87
Synthèse et autres prévisions de la HSEC 88
Anhang 2 : 91
Habitatparameter für die Baue und Latrinen 92
Resultate der Habitatanalyse 95
Logistische und lineare Regressionen 98
Ressourcen-Angebot um die Baue 99
Zusammenstellung der Nachtbeobachtungen 102

© Georges Veya, 1996
Mehrere Untersuchungen in verschiedenen europäischen Ländern haben gezeigt, dass der Dachs (Meles meles) einen Spezialfall innerhalb der Raubtiere bildet. Während die meisten Arten entweder solitär (Sandell 1989) oder in kooperativen Gruppen leben (Gittleman 1989), besitzt dieses Tier innerhalb seines Verbreitungsgebiets eine sehr variable Sozialorganisation.
In ländlichen Gebieten Grossbritanniens leben Dachse in hoher Dichte in sozialen Gruppen ("clans", Kruuk 1978a) von bis zu 35 Individuen (Neal & Cheeseman 1996), die einen gemeinsamen Hauptbau teilen und jeweils ein Territorium gegen benachbarte Gruppen verteidigen. Die Grenzen der Territorien werden mit Geruchssignalen markiert, die durch die Tiere auf Wechsel oder in sogenannte Latrinen bildenden aggregierten Gruben deponiert werden. Gruppen bestehen gewöhnlich aus Tieren beider Geschlechter, obwohl sowohl "rein männliche" (Kruuk 1978a) als auch "rein weibliche" (Cheeseman et al. 1981) Gruppen beobachtet worden sind. Da alle Individuen allein Nahrung suchen, wurden solche scheinbar nicht-kooperative Gruppen von Macdonald (1983) "räumliche Gruppen" genannt.
Andere Untersuchungen haben jedoch gezeigt, dass das oben beschriebene Sozialmuster keine Regel für Dachse in allen Gebieten darstellt. In den intensiver landwirtschaftlich genutzten oder eher städtischen Regionen Grossbritanniens, wo die Dachspopulationen weniger dicht sind, leben Dachse in einem weniger starren Sozialsystem bis hin zu einzeln lebenden und nicht territorialen Individuen (Harris 1982, Harris & Cresswell 1987, Kruuk & Parish 1987, Skinner & Skinner 1988, Cheeseman et al. 1988). In mehreren Populationen Zentral-Europas bilden Dachse wahrscheinlich auch Gruppen, aber zeigen kein eindeu-tiges Territorialverhalten (Stubbe 1989, Graf et al. 1996). In den südlichen Teilen ihres Verbreitungsgebiets, wo sie meist territorial sind, können die Tiere in Paaren leben (Martin-Franquelo & Delibes 1985) oder führen sogar ein solitäres Leben (Pigozzi 1987, beide zitiert in Woodroffe & Macdonald 1993).
Die räumliche Organisation des Dachses ist ebenfalls sehr unterschiedlich. Die Streifgebiete variieren in der Grösse von 14 ha (Cheeseman et al. 1981) bis mehr als 1000 ha (Bock 1987). Indessen scheint die Gruppengrösse nicht in direkter Beziehung mit der Territoriumgrösse zu stehen : d. h. z. B. grosse Gruppen besitzen nicht unbedingt grosse Territorien. Es ist eher so, dass grosse Gruppen in Gebieten mit reichen Nahrungsklumpen vorkommen, die nah beieinander liegen, und folglich nur ein kleines Territorium benötigen (Kruuk & Parish 1982).
Das fakultative Sozialleben des europäischen Dachses hat dazu geführt, dass sich verschiedene Zoologen in den letzten 20 Jahren mit der Frage beschäftigt haben, welche Faktoren die räumliche und soziale Organisation des Dachses beeinflussen bzw. bestimmen. Das Grundprinzip dabei war, Unterschiede in der Sozialstruktur verschiedener Dachspopulationen auf Unterschiede in der Ökologie zurückzuführen, eine Idee die schon bei Crook (1964, zitiert in Krebs & Davies 1981), obwohl auf einem anderen Niveau, in seiner Studie an Webervögeln (Ploceinae) formuliert wurde.
Kruuk (1978b) bzw. Kruuk & Macdonald (1985) schlugen zum Beispiel vor, dass die räumliche und zeitliche Verteilung der Nahrungsklumpen eine wichtige Rolle für die Grösse des Territoriums spielt. Doncaster & Woodroffe (1993) zeigten, dass die Territoriumsgrösse von der Verteilung der Baue bzw. Baustandorte abhängen kann. Schliesslich ist für Cresswell & Harris (1988) die soziale und räumliche Organisation der Dachse mit abnehmender Populationsdichte und zunehmender Unvoraussagbarkeit bzw. Heterogenität des Habitats weniger starr organisiert, weniger territorial und weniger stabil. Alle Untersuchungen zeigten also, dass die Habitatstruktur und die Nahrungsverfügbarkeit ohne Zweifel einen grossen Einfluss auf die Sozialstruktur dieser Art ausüben, lieferten aber bis jetzt keine befriedigende Erläuterungen.
Nach verschiedenen Vorarbeiten wurde im Mai 1995 an der Universität Zürich eine Doktorarbeit von Karin Hindenlang in Angriff genommen. Im Mittelpunkt des Interesses steht die hohe Flexibilität des Dachses in seiner Habitat- und Nahrungswahl. Ein Modell wurde ausgearbeitet (Tab. 1), um zu erklären, wie die Habitatstruktur bzw. das Nahrungsvorkommen die Raumnutzung und Sozialorganisation dieser Tierart beeinflusst.
In meiner Arbeit versuchte ich teilweise zu überprüfen, ob sich die Verhältnis-se in der offenen Kulturlandschaft des Knonaueramts einer der 2 hypothetischen Situationen des vorgeschlagenen Modells annähern. Dafür wurden die nötigen Parameter im Feld so weit und genau wie möglich in drei Schritten aufgenommen.
Tab. 1 :
Vereinfachtes hypothetisches Modell der Dachs-Wildforschungsgruppe der Universität Zürich für 2 "extreme" Habitate (A bzw. Z). Dieses soll eine Prognose der räumlichen und sozialen Organisation der Dachse in Abhängigkeit der jeweiligen Habitatparameter ermöglichen.|
|
"Parameter" |
Habitat A |
Habitat Z |
|
1 |
Habitatqualität |
optimal |
suboptimal |
|
|
Vermutung / Hypothese |
¯ |
¯ |
|
2 |
Nahrungsverteilung |
homogen |
heterogen |
|
3 |
Nahrungsvoraussagbarkeit |
hoch |
niedrig |
|
4 |
Nahrungsnutzungsstrategie |
Spezialist |
Opportunist |
|
|
Vermutung / Hypothese |
¯ |
¯ |
|
5 |
Streifgebietsgrösse |
klein |
gross |
|
6 |
Populationsdichte |
gross |
klein |
|
|
Vermutung / Hypothese |
¯ |
¯ |
|
7 |
Sozialorganisation |
Gruppen, territorial, stabil |
eher solitäre Tiere, nicht territorial, eher labil |
Zuerst erwies sich eine Kartierung der Baue und Latrinen als notwendig. Diese soll einerseits Hinweise auf die Streifgebietsgrösse [5] (Verteilung der Baue und Latrinen) und indirekt auf die Grösse der Populationsdichte [6] (durch die Dichte der Baue) liefern. Ich versuchte folgende Fragen zu beantworten :
Mit der Kartierung der Äcker, Wiesen und Weiden und der periodischen qualitativen (Typus) und quantitativen (Fläche) Bestimmung der durch die Landwirtschaft angebotenen pflanzlichen Nahrung im Knonaueramt wurde dann versucht, einen Einblick in der Nahrungsverteilung [2], der Nahrungsvoraussagbarkeit [3] und folglich der Habitatqualität [1] zu bekommen. Dementsprechend beschäftigte ich mich mit folgenden Fragen :
Als letzter Schritt wurde der Parameter Sozialorganisation [7] durch Nacht-beobachtungen an den Bauen erfasst. Folgende Fragen waren für mich von Bedeutung :
Daneben wurden bestimmte Habitatvariablen gewählt und eine Habitatanalyse der Dachsbaue und -latrinen durchgeführt, um die Hauptkriterien für die Bau- und Latrinenanlage im Knonaueramt zu definieren. Folgende Frage sollte beantwortet werden :
Lässt sich eine Korrelation zwischen der Verteilung der Baue bzw. Latrinen und den gewählten Habitatvariablen erkennen ?
Methoden
© Georges Veya, 1996
Das knapp 16 km2 grosse Untersuchungsgebiet befindet sich im Knonaueramt (ZH) (siehe Abb. 1). Geographisch wird diese Agrarzone des schweizerischen Mittellandes wie folgt begrenzt :
Nach Hindenlang (1992) stellt das Knonaueramt eine "zerschnittene Landschaftsstuktur" dar und wird wie folgt beschrieben : « Die Landschaft wird geprägt durch viel Wiesen- und Weidewirtschaft in mehrheitlich ebenem bis wenig geneigtem Gelände. Darin eingestreut sind wenige kleinflächige Wälder und mehrere Feuchtgebiete. Ein dichtes Strassennetz verbindet die stark zersiedelten Dörfer und verstärkt die Trennung der kleinen Waldflächen ». Deswegen kommt ein wichtiger Stellenwert in diesem waldarmen (17 % Waldfläche gegen 29 % für die Schweiz) und stark anthropogen beeinflussten Landschaftstyp den Wäldern und Waldrandzonen zu, weil sie für die Tiere Deckung und Rückzugsmöglichkeiten bieten.
Baue
Dank Hinweisen der Jagdgesellschaften standen mir die Lage der Dachs- und Fuchsbaue im Knonaueramt auf einer 1:25'000 Karte zur Verfügung. Meine erste Arbeit bestand also in der Ueberprüfung dieser teils aktuellen, teils alten Angaben. Diese fand vom 21. April bis 17. Mai 1997 statt.
Die bewaldeten Teile wurden weiter abgesucht, da neue Baue gegraben werden können und wegen der Deckung nicht unbedingt sofort entdeckt werden. Dafür arbeitete ich nach der folgenden Methode. Wälder mit geringer Wegdichte wurden entlang von Transsekten in einem Abstand von 50 m abgesucht (trotz der manchmal dichten Vegetation hatte ich immer eine Sichtweite von 25 m). Wälder, die dagegen voll von Wegen waren, wurden teils mit dem Fahrrad auf den Wegen, teils zu Fuss entlang Transsekten abgesucht.
Hingegen wurde auf ein systematisches Absuchen der nicht bewaldeten Teile (Äcker, Wiesen, Weiden, Gärten und Dörfer) des Gebiets verzichtet, um die gleichzeitige Aufnahme der Habitatparameter – auf welche die rasche Vegetationsentwicklung einen nicht vernachlässigbaren Einfluss ausübt – in möglichst kurzer Zeit zu beenden. Da aber die Jagdaufseher viel Erfahrung haben und ihr Gebiet gut kennen, nahm ich an, dass keine andere Baue in den offenen Flächen zu finden waren.
(Abb. 1)
Latrinen
Die Kartierung der Latrinen wurde jeweils in Verbindung mit der Kartierung der Baue durchgeführt. Hier wieder suchte ich die bewaldeten Zonen systematisch ab, entweder entlang von parallelen Transsekten (Distanz 10 m) oder inerhalb von konzentrischen Kreisen (Radius jeweils um 10 m vergrössert) um den Bau. Offene Flächen wurden aus zeitlichen Gründen gerichtet abgesucht : Weg-, Bach- und Waldränder, entlang von Zäunen, usw.
Aecker, Wiesen und Weiden
Um die räumliche Verteilung des potentiellen pflanzlichen Nahrungsangebots der Dachse im Knonaueramt zu erfassen, wurde vom 20. Mai bis 14. Juni 1997 eine Landnutzungskarte durch Kartierung des Untersuchungsgebiets erstellt. Dabei wurde zwischen Dauergrünland (Wiesen, Weiden) und Ackerland (verschiedene Getreide-Arten, Hackfruchtbau) unterschieden. Beim Wies- und Weideland wurden zusätzlich Flächen mit Obstbäumen (Apfel-, Kirsch-, Birnbäume, u.s.w.) ausgeschieden. Die Geländeerkundung während der Kartierung der Baue und Latrinen erlaubte mir die in der Tab. 2 aufgelisteten Kategorien zu unterscheiden.
Nach der Kartierung des Gebiets wurde eine qualitative und quantitative Erfassung des pflanzlichen Angebotes periodisch durchgeführt, um die zeitliche Verfügbarkeit und Verteilung dieser Ressourcen zu bestimmen. Feldaufnahmen wurden während den drei folgenden Perioden durchgeführt :
Die im Feld auf 1:5'000 Karten abgegrenzten Flächen wurden am Geographischen Institut der Universität Zürich digitalisiert und mit dem Computer-Programm Arc/Info (V. 7.1.1) ausgemessen. Das Angebot um die verschiedenen Baue wurde mit ArcView Gis (V. 3.0a) analysiert. Die in dieser Arbeit dargestellten Karten wurden im Rechnenzentrum der ETH Zürich gedruckt.
Tab. 2 :
Liste der betrachteten Kategorien für die Erstellung der Landnutzungskarte.|
1 = Ackerland |
2 = Wiesland |
3 = Weideland |
4 = Anders |
|
1e = Nackte Erde |
2g = geschnittenes Gras |
3k = Kuh-Weide |
G = Garten |
|
1m = Mais (Zea mays) |
2k = kurzes Gras |
3p = Pferde-Weide |
|
|
1w = Weizen (Triticum sp.) |
2l = langes Gras |
3s = Kleinvieh-Weide |
|
|
1g = Gerste (Hordeum sp.) |
|
3b = Obstgarten |
|
|
1h = Hafer (Avena sativa) |
|
3a = Anderes, unbestimmt |
|
|
1r = Roggen (Secale cereale) |
|
|
Speziell |
|
1d = Dinkel (Triticum spelta) |
|
|
' = mit mind. |
|
1t = Tritical (Triticum x Secale) |
|
|
einem Obstbaum |
|
1b = Raps (Brassica napus) |
|
|
* = mit Zaun |
|
1f = Futterrübe (Beta vulgaris) |
geschnitten : bis 10 cm |
|
|
|
1k = Kartoffeln (Solanum tuberosum) |
kurz : bis 20 cm |
Kleinvieh : Schafe, Ziege |
|
|
1v = Rebe (Vitis vinifera) |
lang : mehr als 20 cm |
Anderes : Kaninchen,... |
|
Vom 21. Mai bis 2. August 1997 wurden gleichlaufend mit der Landschaftskartierung "nächtliche" Beobachtungen an einigen Bauen gemacht. Ein mobiler Hochsitz und ein Nachtsichtgerät standen mir zur Verfügung. Pro Bau wurde jeweils versucht, an 2 bis 3 aufeinander folgenden Abenden zu beobachten. Aufgenommen wurde die Zeit des Austretens, die Anzahl austretender Tiere, ihr "Alter" (Adulte, Jungen), sowie meteorologische Daten.
2.4. Erfassung der Habitatparameter
Im Feld wurden für jeden gefundenen Bau bzw. für jede gefundene Latrine (benutzt oder nicht) 16-21 verschiedene Habitatparameter (Protokoll-Blatt, siehe Anhang 2, Tab. 17) untersucht. Weitere Variablen wurden mithilfe von Kartenmaterial und den im GIS eingegebenen Daten bestimmt.
Die Herkunft und die Klassifizierung der insgesamt 39 aufgenommenen Variablen sind in den Tab. 15 & 16 (Anhang 2) aufgelistet. Die Erfassungsmethoden der in 5 Kategorien geteilten Parameter erfordern jedoch weitere Erläuterungen, die in den folgenden Abschnitten gegeben werden.
Bau- und Latrinen-Merkmale
Die Aktivität (Dachs, Fuchs, beide, andere) wurde anhand der in der Tab. 2 aufgelisteten Spurentypen bestimmt, die in der Nähe der Baue gefunden werden können. Es wurde immer nach der gleichzeitigen Präsenz mehrerer Spuren gesucht, um die Zuverlässigkeit der Bestimmung zu erhöhen.
Betreffend die Latrinen war die Aufgabe viel einfacher. Da Füchse ihren Kot nicht in Latrinen, sondern an sehr wechselnden meist markanten Stellen (auf Baumstrünken, Grenzsteinen, grossen flachen Steinen,...) (Labhardt 1996) absetzen, sind Dachslatrinen eindeutig zuzuordnen.
Die Intensität der Nutzung der verschiedenen Baue und Latrinen wurde anhand folgender Merkmale geschätzt. Dachsbaue mit noch erkennbaren Rinnen und Erdhaufen, deren Eingangsröhren aber Spinnennetze oder verschiedene Naturmaterialien (tote Blätter, Holzstücke, Steine,...) enthielten, wurden als "nicht benutzt" (Wert "0") taxiert. Solche, wo eine bis zwei Röhren gesäubert waren, aber nur wenige Aktivitätszeichen (siehe Tab. 3) vorhanden waren, wurden als "benutzt" (Wert "1") bezeichnet. Schliesslich wurden die Baue mit gesäuberten Röhren, mit frischen Erdhaufen/Rinnen, benutzten Latrinen (siehe unten) und/ oder ausgetretenen Wechseln als "stark benutzt" (Wert "2") klassiert. Fuchsbaue erhielten entsprechend den Wert "0", wenn sie nicht bewohnt waren. Solche mit gesäuberten Röhren, aber ohne speziellen Geruch und mit altem Kot in Baunähe erhielten den Wert "1" (benutzt). Stark benutzte Baue, mit starkem Geruch, klaren Trittsiegeln, sowie frischen Kothaufen und/oder Nahrungsresten (v. a. Geflügelfedern oder -knochen) wurden mit dem Wert "2" taxiert.
Tab. 3 :
Liste der verschiedenen Spuren, die durch Dachse und Füchse vor den Bauen bzw. in der Nähe ihrer Baue hinterlassen werden. Einzelne Spuren können nicht als zuverlässige Bestimmungsmerkmale betrachtet werden. [Zusammengestellt aus Informationen von Blaser (1975), Déom (1982), Hainard (1987) und Bourand (1989)].|
Spurentypen |
Dachs |
Fuchs |
|
Haare |
artspezifisch |
artspezifisch |
|
Trittsiegel |
artspezifisch |
artspezifisch |
|
Geruch |
kein |
stark |
|
Rinne vor den Röhren |
ja |
keine |
|
Erdaushübe vor den Röhren |
ja |
keine |
|
Blätterhaufen, trockene Gräser oder Heu um die Röhren |
oft |
nie |
|
Nahrungsreste vor dem Bau |
nie |
oft |
|
Wechsel um den Bau |
ja |
wenn ja, nicht immer so deutlich |
|
Kotgruben in der Nähe des Baues |
ja |
nie |
Dieselbe Ordinal-Skala wurde für die Latrinennutzung angewendet, und dies mit folgenden Richtlinien. Latrinen ohne Kot erhielten den Wert "0" (nicht benutzt). Solche mit 1 bis 2 alten Kothaufen bzw. nur 1 frischen Kot gaben wir den Wert "1" (benutzt). Den Wert "2" (stark benutzt) brauchte ich für Latrinen, wo mindestens 3 bis 4 Kothaufen erkennbar waren, und davon mindestens 1 bis 2 noch frisch waren. Unklare Fälle wurden periodisch überprüft.
Um einen Eindruck der Grösse der Baue bzw. Latrinen zu bekommen, betrachtete ich die Ausdehnung der Baue, indem ich jeweils die Distanz zwischen den zwei entferntesten Röhren bzw. Gruben mass, und dies sowohl für die Länge, als auch für die Breite.
Auch die Anzahl Röhren/Gruben bzw. die Anzahl benutzter Röhren/Gruben der Baue/Latrinen wurde ermittelt. Röhren betrachtete ich als benutzt, wenn sie nicht durch Spinnennetze und/oder verschiedene Materialien obstruiert waren. Wichtig war aber auch, dass die Fläche um das Loch ausgetreten und nicht von Falllaub u.s.w. bedeckt war. Gruben wurden als benutzt taxiert, wenn sie 1 oder mehrere Kot(haufen) enthielten, egal ob frisch oder nicht.
Geographie / Topographie
X- und Y-Koordinaten der Baue und Latrinen ermittelte ich mit dem GIS. Die Höhe ü. M. wurde auf der 1:25'000 Landeskarte (Albis, N° 1111, Bundesamt für Landestopographie) bzw. auf 1:5'000 Gemeindekarten (Aeugst a. A., Rifferswil, Hausen a. A., Kappel a. A.; Meliorations- und Vermessungsamt des Kantons Zürich) gemessen bzw. interpoliert. Für die Messung der Hangneigung und der Exposition benutzte ich einen Kompass (Modell DP 6 von Recta). Schliesslich wurde noch versucht, die Topographie um den Bau zu charakterisieren.
Geologie / Pedologie
Bodenkundliche Informationen lieferte das Blatt 225 (Kanton Zürich, 1:50'000) der Bodeneignungskarte der Schweiz (1980), die mir vom Kartographischen Institut der ETH Zürich zur Verfügung gestellt wurde. Die Beschaffenheiten der verschiedenen Bodentypen, die für die Dachse wichtig sein können, betreffen vor allem ihre Grabbarkeit (Gründigkeit, Körnung und Skelettgehalt) sowie ihre Durchlässigkeit und Vernässung.
Habitat und Vegetation
Zuerst wurde versucht, den Habitattyp der Dachsbaue im Knonaueramt zu charakterisieren. Es wurden die gleichen Klassen wie in Grossbritanien (Neal & Cheeseman 1996, siehe Tab. 16, Anhang 2) verwendet. Für die Wälder wurde eine Abschätzung der Laubholz- bzw. Nadelholzanteile nötig. Dafür betrachtete ich jeweils alle Bäume (> 2 m), die von der Mitte des Baues sichtbar waren.
Weiter wurde die Entwicklungsstufe, der Mischungsgrad und die Hauptbaumart des Waldbestandes ermittelt. Dafür betrachtete ich nur noch die Bäume (Höhe > 2 m) in der direkten Umgebung der Baue bzw. Latrinen, d. h. in einem 400 m2 grossen Quadrat.
Die Bestimmung des Deckungsgrades der verschiedenen Vegetationsschichten wurde nach der Methode von Braun-Blanquet (1964) durchgeführt. Für die Baumschicht wurde wieder ein 400 m2 grosses Quadrat als Probefläche gewählt, während für die Strauchschicht und die Krautschicht eine Fläche von 100 m2 repräsentativ ist. Da die Moosschicht manchmal durch Gräser, Blätter, oder Holzstücke bedeckt wird, ist es schwierig ihren Deckungsgrad auf einer grossen Fläche zu schätzen. Deswegen wählte ich fünf 1 m2 grosse Quadrate als Probeflächen und berechnete anschliessend den Mittelwert.
Für Latrinen in offenen Feldern wurde nur der Habitattyp bestimmt.
"Ökologische" Lage
Schlussendlich interessierte ich mich für die "ökologische" Lage der verschiedenen Baue und Latrinen in der Kulturlandschaft des Knonaueramtes. Von Bedeutung waren die Entfernung vom Waldrand, sowie die Distanzen zum nächsten Bau, Wasserlauf, Weg (unasphaltiert) und zur nächsten Strasse (asphaltiert, Autoverkehr). Auch die Nähe von Getreidefeldern (Mais, Weizen, Gerste, Hafer), Obstgärten und geschnittenen Wiesen wurde gemessen. Alle diese Distanzen ermittelte ich mit dem GIS nach Digitalisierung der Bau- und Latrinenstandorte, des Gewässernetzes und der vorher erwähnten Landwirtschaftsflächen. Schliesslich wurden alle Distanzen für die statistische Auswertung in Klassen aufgeteilt.
2.5. STATISTISCHE AUSWERTUNGEN
Die Statistische Auswertungen wurden mit Excel 5.0 (PC/Macintosh) und dem Statistikpaket SPSS (V. 6.1 für Macintosh) gemacht.
Die gesammelten Habitatdaten waren zuerst Gegenstand einer univariaten Analyse, um die Merkmale der Baue bzw. Latrinen und ihrer Lage klarzustellen. Mögliche Tendenzen wurden mit einem Mann-Whitney U-Test bzw. mit einer Kruskall Wallis One-Way Analysis of Variance (für 2 bzw. 3 unabhängige Stichproben) getestet.
Da aber in der Natur alle Faktoren zusammenwirken können, wurde in einer zweiten Phase eine multivariate Analyse durchgeführt. Dabei sind drei Schritte zu unterscheiden :
Die Voraussetzungen der zwei letzten Anwendungen waren aber knapp erfüllt bzw. leicht verletzt, da die Anzahl gefundener Baue klein im Vergleich zu der Anzahl betrachteten Parameter war. Zu wenige Latrinen wurden gefunden, um dieselbe Auswertung mit den Latrinendaten durchzuführen.
© Georges Veya, 1996
Anzahl, Dichte und Verteilung der Baue
Im Untersuchungsgebiet wurden 43 Baue gefunden, was einer Dichte von 2.69 Baue/100 ha entspricht. 22 Baue waren von Füchsen (1.37/100 ha), 9 von Dachsen (0.56/100 ha) und 10 von beiden Tierarten (0.62/100 ha) bewohnt bzw. angelegt. Die 2 letzten Baue wurden wegen dem kleinen Durchmesser der einzelnen Röhren in der Kategorie "Andere" eingereiht. Nach der Anzahl Röhren und verschiedenen im Feld gemachten Beobachtungen unterschied ich dann 6 Dachs-Hauptbaue und 13 Dachs-Nebenbaue (vgl. Punkt 3.3.).
Die Abb. 2 zeigt die Verteilung der Baue im Knonaueramt. Diese wurden exklusiv in den nur 17 % der Fläche ausbildenden bewaldeten Zonen angelegt, was deutlich auf eine aktive Selektion dieser Gebiete hindeutet. An zwei Orten (Seleger Moor und Gom) waren die Baue besonders geklumpt (10 bzw. 9 Baue). Es fällt auf, dass die Dachs-Hauptbaue sowohl in kleinen als auch in grossen Wäldern angelegt wurden und dass gewisse grosse Wälder gar nicht besiedelt werden. Die mittlere Entfernung zum nächsten Bau beträgt 126 m. Weitere Daten für die verschiedenen Baukategorien sind in der Tab. 4 gegeben (siehe auch Abb. 24). Es ist interessant zu sehen, dass die Distanzen "Dachs-Dachs" und "Fuch-Fuchs" jeweils grösser sind als die mittlere Entfernung zwischen den Bauen beider Arten ("Dachs-Fuchs").
Tab. 4 :
Mittlere Entfernung [m] zum nächsten Bau aufgeschlüsselt nach Bautypen. DHB = Dachs-Hauptbau, DNB = Dachs-Nebenbau. Die Zahlen in Klammern entsprechen der Anzahl Baue.|
Dachs-Dachs |
DHB-DHB |
DNB-DHB |
Dachs-Fuchs |
Fuchs-Fuchs |
|
294 (19) (19) |
1'485 (6) |
224 (13) |
126 (19) |
192 (22) |
Standortscharakteristika
Bau-Merkmale
(siehe Abb. 3-5)Bezüglich der Intensität der Benutzung waren 40 % aller Baue stark benutzt, 26 % benutzt und die übrigen temporär gelassen. Die Anzahl Röhren pro Bau variierte zwischen 1 und 34, mit einem Durschnitt von 5.60. Signifikante Unterschiede wurden zwischen gewissen Bau-Kategorien gefunden, wie Tab. 5 zeigt. Fuchsbaue hatten eindeutig weniger Röhren als "gemischte" Baue ("Dachs+Fuchs"), aber nicht signifikant weniger als "reine" Dachsbaue. Fuchsbaue hatten auch deutlich weniger Röhren als alle Baue, die von Dachsen bewohnt waren ("Dachs gesamt"). Benutzte Röhren fand ich zwischen 1 und 15, mit einem Mittelwert von 4.00 pro benutzter Bau.
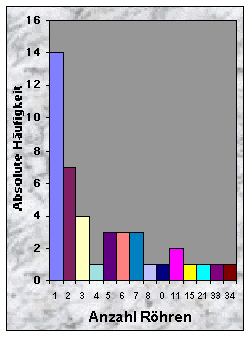
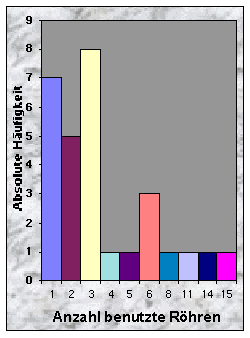
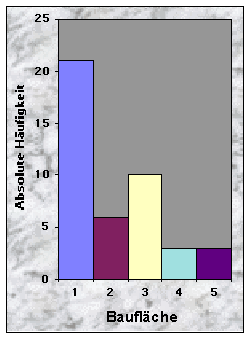
Abb. 3-5 :
Anzahl Röhren, Anzahl benutzte Röhren und Fläche der gefundenen Baue (n = 43). Die Flächen wurden in folgenden Klassen eingeteilt : 1: £ 10 m2, 2: £ 100 m2, 3: £ 400 m2, 4: £ 900 m2, 5: ³ 900 m2.Tab. 5 : Minimale, maximale und mittlere Anzahl Röhren für die verschiedenen Bautypen. Mögliche Unterschiede wurden mit dem Mann-Whitney U-Test (two-tailed) für 2 unabhängige Stichproben untersucht. "Dachs gesamt" = "Dachs" + "Dachs+Fuchs".
|
Kategorie |
min |
max |
|
Vergleiche |
|
|
Fuchs |
1 |
7 |
2.41 |
"Dachs" vs. "Dachs+Fuchs" "Fuchs" vs. "Dachs+Fuchs" "Fuchs" vs. "Dachs" "Fuchs" vs. "Dachs gesamt" |
p < 0.01 p < 0.0001 p > 0.10 p < 0.001 |
|
Dachs |
1 |
10 |
4.11 |
||
|
Dachs+Fuchs |
1 |
34 |
14.80 |
||
|
Dachs gesamt |
1 |
34 |
9.74 |
||
Die Ausdehnung der untersuchten Baue variierte zwischen 0.3 und 65 m in der Länge bzw. 0.3 und 35 m in der Breite. Die mittlere Baufläche betrug 49.6 m2 für Fuchsbaue, 296 m2 für Dachsbaue und 567.5 m2 für Baue, wo beide Arten vorhanden waren. Ein stark signifikanter Unterschied wurde zwischen diesen Kategorien gefunden (Kruskall Wallis 1-Way Anova, two tailed; p < 0.001).
Geographie / Topologie
(siehe Abb. 6-8)Die Baue im Knonaueramt wurden zwischen 526 und 736 m Höhe ü. M. gefunden, was dem Angebot entspricht (524 m bzw. 741 m ü. M. für die zwei extremen Höhepunkte im Gebiet). 37 % waren an südexponierten Hängen (135-225°) angelegt, gegen 23 % an Westhängen und nur 7 % bzw. 5 % gegen Nord bzw. Ost. Hier scheinen die Dachse selektiv zu sein, da die meisten Wälder Hänge besitzen, die ein breites Spektrum von Orientierungen zeigen. Die übrigen 28 % betrafen Baue, die an ebenen Orten gegraben wurden und wo die Röhren keine feste Orientierung zeigten. Den grössten Teil der Baue entdeckte ich entweder an wenig geneigten (19 Baue / 0-20 % Neigung) oder an sehr steilen Hängen (15 Baue / über 40 % Neigung). 51 % der Baue befanden sich an flachen Hängen, gegen 33 % an ebenen Standorten. Konkave und konvexe Hänge wurden gemieden (insgesamt 9 %). Die zwei letzten Resultate scheinen sich aber nicht vom Angebot zu unterscheiden, obwohl dieses nicht quantitativ erhoben wurde.
Geologie / Pedologie
(siehe Abb. 10-13)Die Baustandorte zeichneten sich durch ein breites Spektrum von Bodentypen aus : Cambisol (16 Baue), Gleysol (13), Regosol (11) und Luvisol (3). Die Bodenschicht war häufig mitteltief (37 %), oft aber auch tief (23 %) oder flach (26 %). Da die Angaben über die Bodenkörnung zu grob waren, beschloss ich diesen Parameter wegzulassen. Die meisten Böden waren skelettarm (70 %) und zeigten eine gehemmte bis stark gehemmte Durchlässigkeit (insgesamt 86 %). 63 % waren trocken bis grundfeucht, gegen 30 %, die mässig grundnass waren.
Habitat / Vegetation
(siehe Abb. 14-19)Die Baue fand ich entweder in Misch- (77 %) oder Nadelwäldern (23 %), mit stufigem, ungleichaltrigem (33 %) oder mittlerem Baumholz (35 %). Der Mischungsgrad um die Baue bestand vor allem aus 51-90 % Nadelholz (n = 21), manchmal aber aus fast reinem Laubholz (n = 13). Weisstanne (51 %) und Buche (40 %) waren die beiden häufigsten Baumarten. Der Deckungsgrad der Baumschicht in der Nähe der Baue war immer sehr dicht (n = 34 für mehr als 50 % Deckung), während die Strauch- und Krautschichten nur sehr selten eine Deckung von mehr als 50 % bildeten. Die Moosschicht deckte häufig bis maximal 5 % der betrachteten Fläche (n = 33).
"Ökologische Lage"
(siehe Abb. 20-32)Mehr als die Hälfte der Baue wurden weniger als 50 m vom Waldrand (n = 24) und vom nächsten Weg (n = 30) entfernt gefunden, jedoch selten weniger als 10 m und nie mehr als 250 m. Dagegen waren sie häufiger mehr als 100 m von der nächsten Strasse (79 %) und vom nächsten Wasserlauf (67 %) angelegt.
Baue waren manchmal sehr nah (£ 100 m, n = 10), oftmals aber mehr als 150 m (n = 28) vom nächsten Maisfeld zu finden. Die Entfernung bis zu den nächsten Weizen- (n = 20), Gersten- (n = 24) und Haferfeldern (n = 40) war mehrheitlich länger als 250 m. Felder mit Obstbäumen fand ich sowohl in der Nähe (£ 50 m, n = 10) als auch sehr weit (> 250 m bis 780 m !, n = 15) von Baustandorten.
Die Distanzen zur nächsten geschnittenen Wiese im Juni waren eher gleichmässig verteilt (vgl. Abb. 30). Dagegen waren sie im Juli und im August in der Mehrheit £ 150 m (n = 31) bzw. £ 200 m (n = 41) lang.
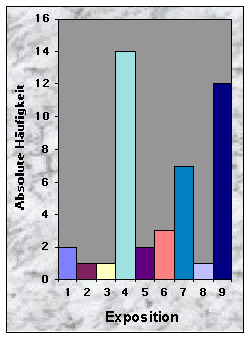
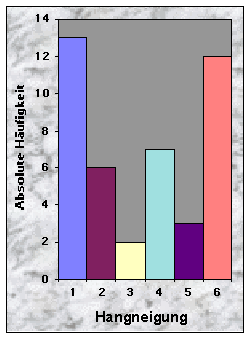
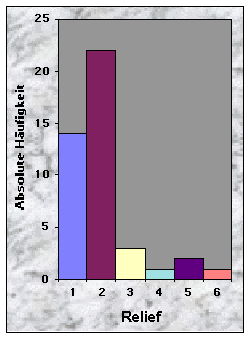
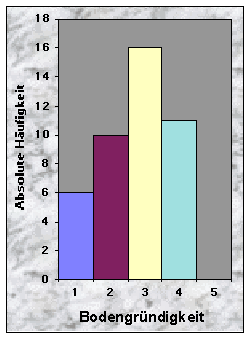
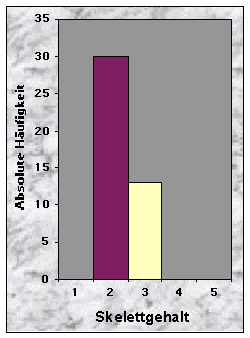
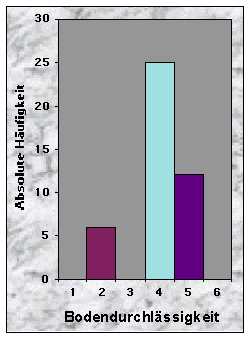
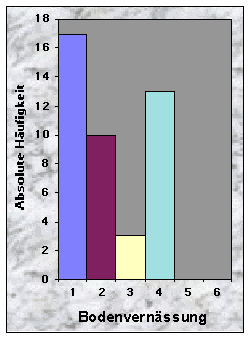
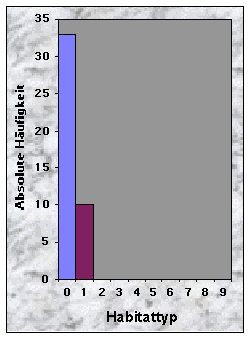
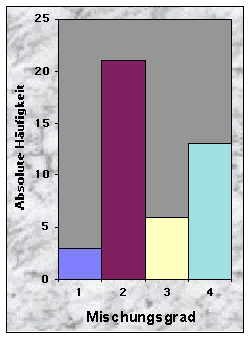
Abb. 6-14 :
Verteilung der Variablen für die 43 gefundenen Baue. Für die Bedeutung der Klassen und die Einheiten der betrachteten Parameter, siehe Tab. 16, Seite 93.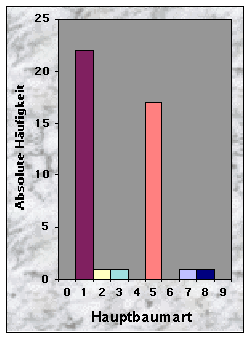
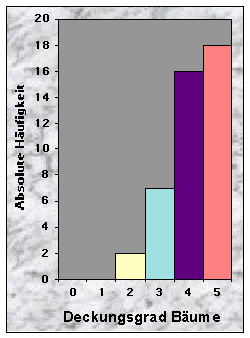
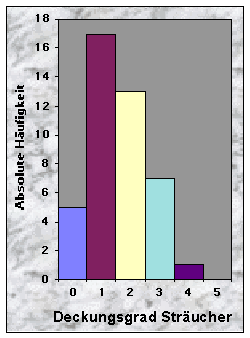
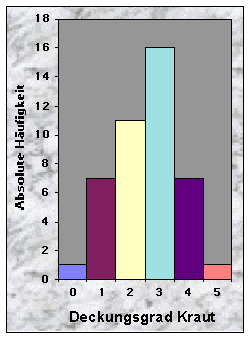
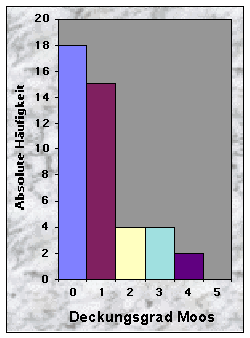
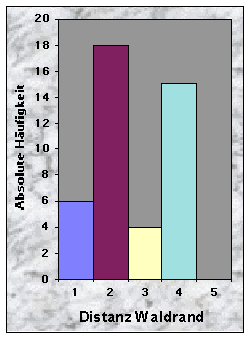
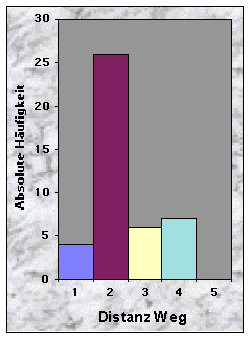
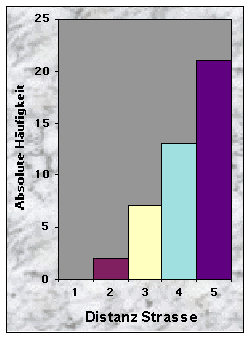
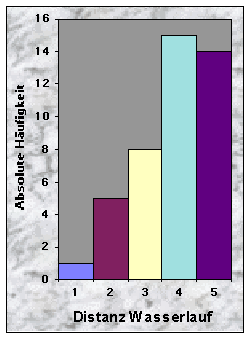
Abb. 15-23 :
Verteilung der Variablen für die 43 gefundenen Baue. Für die Bedeutung der Klassen und die Einheiten der betrachteten Parameter, siehe Tab. 16, Seite 93.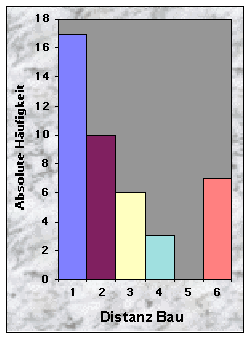
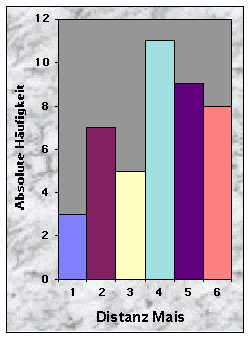
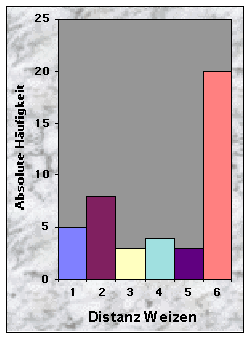
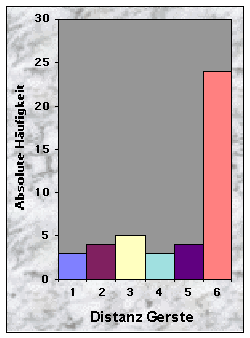
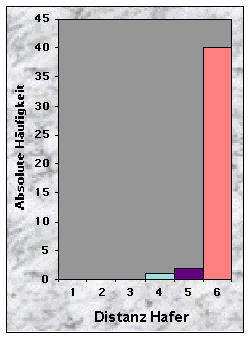
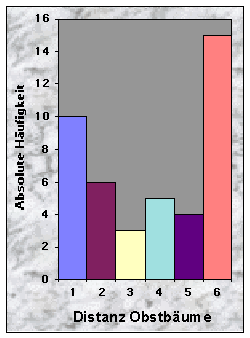
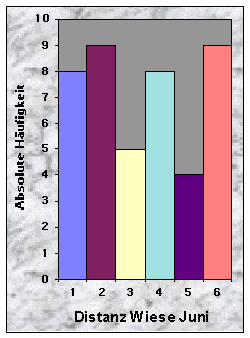
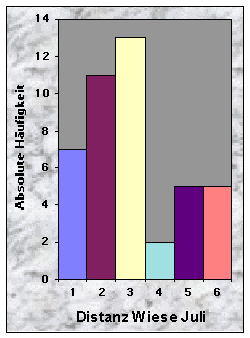
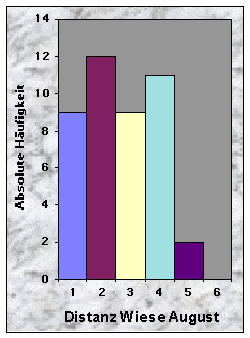
Abb. 24-32 :
Verteilung der Variablen für die 43 gefundenen Baue. Für die Bedeutung der Klassen und die Einheiten der betrachteten Parameter, siehe Tab. 16, Seite 93.Korrelationen zwischen den Variablen
Die Berechnung des Spearman-Korrelationskoeffizienten erlaubte mir eine monotone Korrelation zwischen gewissen Habitatvariablen hervorzuheben. Die Anzahl benutzte Röhren war stark mit der Intensität der Benutzung (r = 0.92) und der Anzahl Röhren der Baue (r = 0.73) korreliert. Eine starke Korrelation wurde auch zwischen der Ausdehnung Länge und der Ausdehnung Breite der Baue (r = 0,93) gefunden, sowie zwischen jeder dieser Variablen und der Anzahl benutzten Röhren (r = 0.92 bzw. r = 0.91). Wie erwartet waren auch die Bodendurchlässigkeit und die Bodenvernässung miteinander korreliert (r = 0.82).
Hauptkomponenten-Analyse
Für die Hauptkomponenten-Analyse wurden wegen der kleinen Anzahl gefundener Baue nur die nach verschiedenen Arbeiten in Europa (Anrys & Libois 1983; Bock 1987, 1988a, 1988b; Thornton 1988; Skinner et al. 1991; Neal & Cheeseman 1996) "wichtigsten" Habitatvariablen betrachtet (13 insgesamt). Die Analyse und Reduzierung der Daten lieferte folgende 4 unabhängige Faktoren :
Tab. 6 :
Zusammenstellung der Resultate der Hauptkomponenten-Analyse für die 13 gewählten Habitatvariablen. Die von den Faktoren erklärten prozentualen Anteile an der Gesamtvarianz sind jeweils unter den Namen der betreffenden Faktoren angegeben. Die "Factor Loadings" > ê 0.64 ê sind hervorgehoben. Negative Vorzeichen der "Factor Loadings" bedeuten keine negativen Beiträge der Variablen bezüglich der Anlage der Baue, sondern erklären nur die Beziehung der Variablen zu den Faktoren. Für die Bedeutung der angewandten Abkürzungen, siehe Tab. 15, Seite 92.|
|
"Feuchtigkeit" |
Boden |
Deckungsgrad |
Entwicklungsstufe |
|
|
26.6 % |
22.3 % |
10.9 % |
10.1 % |
|
BOG |
- 0.059 |
0.934 |
- 0.208 |
- 0.083 |
|
SKG |
- 0.082 |
- 0.643 |
0.152 |
0.515 |
|
BOD |
0.600 |
0.670 |
0.051 |
- 0.028 |
|
BOV |
0.897 |
0.228 |
0.106 |
- 0.046 |
|
EST |
0.132 |
- 0.104 |
0.002 |
0.866 |
|
COMP |
0.752 |
0.170 |
0.454 |
- 0.177 |
|
DGB |
0.105 |
0.049 |
- 0.708 |
- 0.087 |
|
DGS |
0.024 |
- 0.230 |
0.754 |
0.181 |
|
DGK |
0.204 |
- 0.200 |
0.771 |
0.214 |
|
DGM |
0.687 |
0.064 |
0.298 |
- 0.256 |
|
DWG |
0.116 |
0.299 |
- 0.155 |
- 0.522 |
|
DS |
0.702 |
- 0.317 |
- 0.016 |
0.234 |
|
DB |
0.035 |
0.132 |
0.258 |
0.689 |
Wie erwartet spielen die Bodenbeschaffenheiten eine wichtige Rolle für die Anlage der Baue. Dachse scheinen flache, skelettfreie und undurchlässige Böden zu selektieren (Faktor "Boden"). Orte mit dichter Strauch- bzw. Krautschicht und zerstreuter Baumdeckung (Faktor "Deckungsgrad") in relativ alten Holzbeständen (Faktor "Entwicklungsstufe") sollten im Untersuchungsgebiet günstige Bedingungen bieten. Auch eine Präferenz für grundnasse Böden mit dichter Moosschicht wird durch die Resultate nahegelegt (Faktor "Feuchtigkeit").
Logistische bzw. lineare Regression
Keiner der oben beschriebenen Faktoren zeigte einen signifikanten positiven bzw. negativen Einfluss auf die Präsenz der Dachs- bzw. Fuchsbaue (schrittweise multiple logistische Regression), genau wie für die Anzahl (benutzte) Röhren oder für die Ausdehnung (längs/breit) der Baue (schrittweise multiple lineare Regression). Alle Resultate sind in der Tab. 21 (Anhang 2) zusammengestellt.
Anzahl, Dichte, Verteilung und Merkmale der Latrinen
Im Untersuchungsgebiet wurden nur 11 Latrinen gefunden, was einer Dichte von 0.69 Latrine/100 ha entspricht. Die Verteilung der Latrinen ist in der Abb. 2 (Seite 10) dargestellt. Die mittlere Entfernung zum nächsten Dachsbau betrug 83.30 m. Wie ersichtlich wurden 7 Latrinen um einen Hauptbau (Seleger Moor) gefunden, was bei der kleinen Anzahl gefundener Latrinen eine grosse Rolle für die Resultate der Habitatanalyse spielte und sie demzufolge schwierig zu interpretieren macht. Deswegen möchte ich hier nur die wichtigsten Ergebnisse vorstellen.
Bezüglich der Intensität der Benutzung waren 5 Latrinen stark benutzt und 6 benutzt. Die Anzahl Gruben pro Latrine variierte zwischen 1 und 15, mit einem Durschnitt von 5.60. Benutzte Gruben fand ich zwischen 1 und 7, mit einem Mittelwert von 2.70 pro benutzte Latrine. Die Anzahl Kotlosungen pro Grube wurde nicht systematisch aufgenommen; meist gab es aber 2 bis 3 übergelegte Kothaufen pro Loch, wobei die unteren immer alt und trocken waren. Ein "Spezialfall" wurde im Seleger Moor gefunden, wo viele isolierte Kothaufen einfach auf Moospolster abgesetzt wurden. Die Ausdehnung der gefundenen Latrine variierte zwischen 0 und 6 m in der Länge bzw. 0 und 3 m in der Breite. Die mittlere Latrinenfläche betrug 6.80 m2 (maximal 18 m2).
Den grössten Teil der Latrinen entdeckte ich an ebenen Standorten. Nur 2 Latrinen wurden in offenen Feldern gefunden. Die anderen lagen in Misch- oder Nadelwäldern, wo der Deckungsgrad der Baumschicht immer sehr dicht war (> 50 % Deckung) und die Strauch-, Kraut- und Moosschichten nur selten eine Deckung von mehr als 50 % bildeten. Insgesamt fand ich 6 Latrinen in der Nähe von Landmarken. 2 lagen weniger als 10 m vom Waldrand, 2 waren weniger als 15 m vom nächsten Wasserlauf entfernt und die 2 letzten lagen sowohl sehr nah vom nächsten Weg (3 m bzw. 15 m) als auch vom Waldrand (3 m bzw. 2 m). 4 Latrinen wurden weniger als 30 m vom nächsten Bau gefunden, während 5 mehr als 100 m davon entfernt waren. Alle Latrinen wurden dagegen sehr weit von der nächsten Strasse angelegt (331 m im Durchschnitt).
Kartierung und Charakterisierung der Kulturlandschaft
Mittels Digitalisierung der Daten wurde eine Landnutzungskarte erstellt (Abb. 33) und folgende Zahlen ermittelt :
Tab. 7 :
Anzahl, Gesamtfläche und Anteil der verschiedenen Landschaftskategorien im Knonauer-Amt. Stand : Mitte Juni 1997.|
Kategorie |
Anzahl |
Fläche [ha] |
Anteil [%] |
|
Wälder/Baumgruppen |
30 |
274.957 |
17.18 |
|
Äcker |
297 |
329.557 |
20.59 |
|
Wiesen |
746 |
588.496 |
36.77 |
|
Weiden |
338 |
194.412 |
12.15 |
|
Gärten |
84 |
31.282 |
1.95 |
|
Siedlungs-/Feuchtgebiete |
¾ |
181.731 |
11.36 |
|
Total |
1'495 |
1'600.436 |
100.00 |
Zu diesen Resultaten kann man noch hinzufügen, dass die Wälder bzw. Baum-gruppen des Gebiets eine Waldrandlänge von 50.72 km (inklusiv Lichtungen) ausbilden.
Erreichbarkeit der pflanzlichen und tierischen Ressourcen
Von den 1'465 kartierten unbewaldeten Flächen waren 42 (siehe Abb. 34) – meist Gärten mit Metall-Zäunen – für die Dachse absolut unzugänglich, was eine Gesamtfläche von 30.397 ha bzw. einen relativen Anteil von 1.90 % darstellt.
Zeitliche Variation der Gesamtfläche der verschiedenen Aecker-, Wiesen- und Weide-Typen und ihrer räumlichen Verteilung
Die Analyse mit dem Programm Arc/Info lieferte die in der Tab. 8 zusammengestellten Resultate.
Bezüglich ihrer Anzahl und Gesamtfläche zeigten die Gärten während der ganzen Untersuchungsperiode keine Veränderungen, die Weidelandfläche hingegen (86.49 % Grossviehweiden) wurde leicht vergrössert. Die grössten Variationen betreffen das Acker- und Wiesland. Während die Anzahl Äcker und ihre Gesamtfläche von Mitte Juni bis Mitte August in zwei Stufen sank, stiegen diese Parameter für die nackten Felder entsprechend zweistufig an. Im August nahm die Gesamtzahl bzw. -fläche an Wiesen leicht zu, da zu dieser Zeit das Gras auf den geernteten Gerstefeldern gewachsen war. Wiesen mit langem Gras waren im Juni deutlich dominant (59.67 %), während geschnittene Wiesen die Hälfte (50.30 %) der Wiesenfläche im folgenden Monat darstellten. Im August waren sowohl Wiesen mit geschnittenem (44.95 %) als auch mit langem Gras (38.53 %) in der Mehrheit vorhanden.
Die räumliche Verteilung der verschiedenen Flächen-Typen zum Zeitpunkt der drei Aufnahmeperioden ist in den Abb. 35, 36 und 37 dargestellt. Neben den Gärten und Äckern, wurden auch die Weiden fast keinen Ortsveränderungen unterworfen. Bedingt durch die steigende Anzahl von gepflückten Feldern zeigte die Kategorie "Nackte Erde" eine grössere Verbreitung Ende Sommer. Die einzige Landschaftskategorie, die räumlichen Variationen innerhalb der Klassen unterworfen war, war das Wiesland. Da Futtergras von den Bauern ständig gebraucht wird, wurden die Wiesen periodisch gemäht, sodass geschnittenes, kurzes und langes Gras jeweils an wechselnden Orten vorhanden war. Nur die Dauerwiesen (meist an Waldrändern oder steilen Hängen) wurden nicht gemäht und boten von Juni bis August ständig hohes Gras.
Tab. 8 :
Landnutzung im Knonaueramt für die Perioden Mitte Juni, Mitte Juli und Mitte August.|
Kategorie |
Anzahl Felder |
Gesamtfläche [ha] |
|||||||
|
|
Juni |
Juli |
August |
Juni |
Juli |
August |
Mittel |
% |
|
|
Nackte Erde |
1 |
63 |
120 |
0.143 |
68.678 |
140.593 |
69.805 |
6.10 |
|
|
Mais |
101 |
101 |
101 |
114.926 |
114.926 |
114.926 |
114.927 |
10.05 |
|
|
Weizen |
61 |
61 |
0 |
83.986 |
83.986 |
0.000 |
55.991 |
4.90 |
|
|
Gerste |
62 |
0 |
0 |
68.535 |
0.000 |
0.000 |
22.845 |
2.00 |
|
|
Hafer |
11 |
11 |
0 |
9.202 |
9.202 |
0.000 |
6.135 |
0.54 |
|
|
Roggen |
4 |
4 |
0 |
3.573 |
3.573 |
0.000 |
2.382 |
0.21 |
|
|
Dinkel |
7 |
7 |
0 |
6.712 |
6.712 |
0.000 |
4.474 |
0.39 |
|
|
Tritical |
12 |
12 |
0 |
11.698 |
11.698 |
0.000 |
7.799 |
0.68 |
|
|
Raps |
19 |
19 |
0 |
24.171 |
24.171 |
0.000 |
16.114 |
1.41 |
|
|
Futterrübe |
9 |
9 |
9 |
3.610 |
3.610 |
3.610 |
36.097 |
0.32 |
|
|
Kartoffeln |
8 |
8 |
4 |
2.803 |
2.803 |
2.211 |
26.057 |
0.23 |
|
|
Rebe |
2 |
2 |
2 |
0.198 |
0.198 |
0.198 |
0.198 |
0.02 |
|
|
Ackerland Total |
296 |
234 |
116 |
329.414 |
260.879 |
120.945 |
237.079 |
20.73 |
|
|
Wiese : geschnitten |
212 |
330 |
321 |
157.012 |
296.573 |
293.865 |
249.150 |
21.78 |
|
|
Wiese : kurz |
111 |
166 |
128 |
80.302 |
124.601 |
108.030 |
104.311 |
9.12 |
|
|
Wiese : lang |
423 |
249 |
340 |
351.183 |
168.441 |
251.929 |
257.184 |
22.49 |
|
|
Wiesland Total |
746 |
745 |
789 |
588.496 |
589.615 |
653.824 |
610.645 |
53.39 |
|
|
Kuh-Weiden |
250 |
251 |
267 |
167.768 |
166.649 |
170.805 |
168.408 |
14.72 |
|
|
Pferde-Weiden |
15 |
15 |
17 |
3.103 |
3.103 |
3.204 |
3.137 |
0.27 |
|
|
Kleinvieh-Weiden |
33 |
33 |
32 |
7.235 |
7.235 |
7.126 |
7.199 |
0.63 |
|
|
Obstgärten |
19 |
19 |
19 |
9.136 |
9.136 |
7.916 |
8.729 |
0.76 |
|
|
Anderes, unbestimmt |
21 |
21 |
22 |
7.169 |
7.169 |
7.368 |
7.236 |
0.63 |
|
|
Weideland Total |
338 |
339 |
357 |
194.412 |
193.29 |
196.421 |
194.708 |
17.02 |
|
|
Gärten |
84 |
84 |
83 |
31.282 |
31.282 |
31.965 |
31.510 |
2.75 |
|
|
Total |
1'465 |
1'465 |
1'465 |
1'143.747 |
1'143.747 |
1'143.747 |
1'143.747 |
100.00 |
|
Ressourcen-Angebot um die Baue
Um zu untersuchen, ob das Habitat in der direkten Umgebung der Baue der Tiere heterogen und variabel erscheint, wurde das Angebot an Äckern, Wiesen, Weiden und bewaldeten Zonen im Umkreis von 166 m Radius um die Baue (siehe Abb. 38) mit dem GIS berechnet. Die entstehenden 87 ha grossen Flächen entsprechen der mittleren Territoriumsgrösse der Dachse in Wytham (Kruuk 1978a). Detaillierte Angaben für einzelne Baue befinden sich im Anhang 2 (Tab. 21-23). Hier werde ich nur das mittlere Angebot (für alle Baue) kommentieren (Tab. 9).
Die grosse Anzahl (Wert ¹ 0 in Tab. 9) an Äcker-, Wiesen- und Weide-Typen in den einzelnen Reihen (Juni, Juli, August) zeigt gut, wie heterogen das Habitat aussieht. Wichtig ist, dass die Wälder (plus z. T. Feuchtgebiete) 61 % des Flächen-Angebots ausbilden, die Wiesen und Weiden im Mittel 21.49 % bzw. 7.85 %, die Äcker nur 5.52 %. Weiter deuten die Unterschiede zwischen den verschiedenen Monaten hin, dass das Ressourcen-Angebot zeitlich variabel ist. Vor allem fallen die kontinuierliche Abnahme des Getreide-Angebots von Juli bis August und der grössere Anteil an geschnittenen Wiesen (Regenwürmer !) im August auf. Schliesslich zeigen die grossen Werte der Standardabweichungen die Diskrepanz des Angebots zwischen den einzelnen Bauen.
Tab. 9 :
Mittleres Angebot an Äckern, Wiesen, Weiden und bewaldeten Zonen um die Baue (n = 43, Flächen in m2). Die Ziffern in Klammern stellen die Standardabweichungen dar.|
Kategorie |
Juni |
Juli |
August |
|
Siedlungsgebiete |
88 (402) |
88 (402) |
88 (402) |
|
Nackte Erde |
0 (0) |
1'861 (3'841) |
4'301 (5'982) |
|
Mais |
1'860 (2'925) |
1'860 (2'925) |
1'860 (2'925) |
|
Weizen |
3'541 (5'683) |
3'541 (5'683) |
0 (0) |
|
Gerste |
1'861 (3'841) |
0 (0) |
0 (0) |
|
Hafer |
15 (96) |
15 (96) |
0 (0) |
|
Roggen |
0 (0) |
0 (0) |
0 (0) |
|
Dinkel |
277 (686) |
277 (686) |
0 (0) |
|
Tritical |
262 (1'348) |
262 (1'348) |
0 (0) |
|
Raps |
204 (733) |
204 (733) |
0 (0) |
|
Futterrübe |
24 (154) |
24 (154) |
24 (154) |
|
Kartoffeln |
27 (121) |
27 (121) |
27 (121) |
|
Rebe |
0 (0) |
0 (0) |
0 (0) |
|
Wiese : geschnittenes Gras |
6'546 (8'333) |
6'995 (9'449) |
9'159 (11'126) |
|
Wiese : kurzes Gras |
1'337 (2'868) |
4'557 (6'544) |
3'366 (6'599) |
|
Wiese : langes Gras |
9'784 (1'366) |
6'529 (6'719) |
7'517 (6'488) |
|
Kuh-Weiden |
6'484 (8'942) |
6'070 (8'746) |
5'896 (8'538) |
|
Pferde-Weiden |
0 (0) |
0 (0) |
0 (0) |
|
Kleinvieh-Weiden |
124 (518) |
124 (518) |
124 (518) |
|
Obstgärten |
496 (1'573) |
496 (1'573) |
551 (1'632) |
|
Weiden (andere, unbestimmt) |
0 (0) |
0 (0) |
19 (120) |
|
Gärten |
522 (2'740) |
522 (2'740) |
522 (2'740) |
|
Wald, Feuchtgebiete |
53'072 (23'587) |
53'072 (23'587) |
53'072 (23'587) |
|
Total |
86'526 (0) |
86'526 (0) |
86'526 (0) |
Zeitliche Verfügbarkeit der verschiedenen Getreide-Arten
Da Dachse Getreide vor allem im "Milchstadium" fressen, wurde das Gebiet von Mitte Juni bis Mitte August periodisch befahren, um den Zeitpunkt des Milchstadiums und der Ernte der verschiedenen Getreide-Arten abzuklären (Tab. 10). Das Getreide-Angebot für die drei Aufnahmeperioden ist auf die Abb. 35, 36 und 37 durch rosa (Mais, Weizen), violette (Gerste, Hafer) und blaue (Roggen, Dinkel, Tritical) Farben gekennzeichnet.
Gerste wurde als erste Nahrungsquelle von Mitte bis Ende Juni für Dachse verfügbar. Dann standen Weizen, Hafer, Roggen, Dinkel und Tritical ab der zweiten Juli-Woche zur Verfügung, und dies bis ungefähr Ende Juli. Schlussendlich war Mais ab dem zweiten Drittel des Augusts zugänglich. Mann sieht also, dass 3 "Bottleneck"-Perioden bezüglich des Getreide-Angebots anfangs Juni, Juli und August vorhanden sind. Wenn man das Gesamtangebot für die drei Aufnahme-Perioden quantitativ betrachtet, so ist dieses im Juli und August ungefähr gleich gross (115.171 ha bzw. 114.926 ha) aber grösser als im Juni (68.535 ha). Mais allein stellt 38.48 % aller Getreide-Aecker dar, Weizen (28.12 %) und Gerste (22.95 %) machen ebenfalls einen grossen Anteil aus.
Tab. 10 :
Saat- und Ernteperioden, sowie Anfang des "Milchstadiums" der verschiedenen Getreide-Arten im Sommer 1997 im Knonaueramt. Aufgrund einer Befragung von Bauern wird eine mögliche Verteilung (grob) der Getreide-Arten für das Jahr 1998 vorgeschlagen. 6R = Ähre mit 6 Reihen, 2R = Ähre mit 2 Reihen.|
Getreide-Art |
Saat |
Milchstadium |
Ernte |
1998 |
|
Herbst-Gerste (6R) |
Ende Sept. – Mitte Okt. |
ab Mitte Juni |
7.-15. Juli |
Maïs |
|
Herbst-Gerste (2R) |
Ende Sept. – Mitte Okt. |
ab Mitte Juni |
7.-15. Juli |
Maïs |
|
Frühling-Gerste (2R) |
Mitte Februar – März |
ab 23. Juni |
14.-23. Juli |
Maïs |
|
Herbst-Weizen |
Mitte Okt. – Mitte Nov. |
ab 7. Juli |
4.-9. August |
Hafer |
|
Frühling-Weizen |
Mitte Februar – März |
ab Mitte Juli |
11.-15. August |
Hafer |
|
Herbst-Roggen |
Ende Sept. – Anfang Okt. |
ab 7. Juli |
4.-15. August |
Gerste, Mais, Futtergras |
|
Dinkel |
Anfang Okt. – Anfang Dez. |
ab 7. Juli |
4.-15. August |
Gerste, Mais, Futtergras |
|
Tritical |
Anfang – Ende Oktober |
ab 7. Juli |
4.-15. August |
Gerste, Mais, Futtergras |
|
Herbst-Hafer |
Ende Sept. – Anfang Okt. |
ab 7. Juli |
4.-9. August |
Weizen |
|
Frühling-Hafer |
Februar – März |
ab Mitte Juli |
11.-15. August |
Weizen |
|
Maïs |
20. April – 20. Mai |
ab 11. August |
20. Sept. bis November |
Weizen |
Räumliches und zeitliches Obstangebot
Von Anfang Juni bis Ende August 1997 wurde auch das Obstangebot im Knonaueramt untersucht. Wie erwartet sind Kirsch-, Apfel- und Birnbäume die meist gepflanzten Arten, wobei auch einige Pflaumen- bzw. Zwetschgenbäume gefunden wurden. Reben (0.198 ha) waren nur an einem Bauernhaus in der Nähe von Uerzlikon zu finden.
Insgesamt wurden 259 Flächen gefunden (d. h. 22.17 % aller Wiesen, Weiden und Gärten), die 1 bis 20 Obstbäume enthielten. Die Verteilungskarte (Abb. 39) der Obstbäume zeigt gut, dass Früchte vor allem in der Nähe von Dörfern bzw. Bauernhöfen (braune Zonen) zu finden sind.
Kirschen waren im Untersuchungsgebiet von ca. Mitte bis Ende Juni reif. Je nach Art und Ort standen noch einige Bäume bis Mitte Juli zur Verfügung. Diese Früchte wurden aber sehr rasch und ständig gepflückt, sodass das Angebot am Boden unbedeutend war. Ähnlich sah es mit den Ernte-Äpfeln im Monat Juli aus, wobei 4 bis 6 gefallene Aepfel dem Dachs wahrscheinlich mehr bringen als 20 Kirschen. Weitere Aepfelsorten waren dagegen im August am Boden reichlich vorhanden. Pflaumen bzw. Zwetschgen werden nicht alle gleichzeitig reif, sodass das Angebot am Boden ab der zweiten August-Woche ständig bedeutend war. Da Birnen und die Weintraube nur im September reif sind, war ihr Angebot bis Ende August dementsprechend gleich null.
Weiteres pflanzliches Angebot im Knonaueramt
An Waldrändern und in den wenigen Hecken (Ausnahme : Heidelbeeren im Seleger Moor) wurde auch das potentielle Wildfrüchteangebot grob untersucht (siehe Tab. 11). Die meisten Früchte waren aber für den Dachs auf den Sträuchern bzw. Bäumen unzugänglich (höher als 1 m), während das Angebot am Boden unbedeutend war.
Tab. 11 :
Liste der im Knonaueramt meist getroffenen Wildobstarten mit Angabe der Reifeperiode ihrer Früchte.|
Deutscher Name |
Lateinischer Name |
Reife |
|
Wildkirsche |
Prunus avium |
Ab. Mitte Juni |
|
Eberesche |
Sorbus aucuparia |
September-Oktober |
|
Mehlbeere |
Sorbus aria |
Ab. Mitte Juli |
|
Weissdorn |
Crataegus sp. |
Oktober |
|
Hundsrose |
Rosa canina |
Oktober-November |
|
Schwarzer Holunder |
Sambucus nigra |
Oktober-November |
|
Wolliger Schneeball |
Viburnum opulus |
Ab. Mitte August |
|
Gemeiner Schneeball |
Viburnum lantana |
Ab. Mitte August |
|
Rote Heckenkirsche |
Lonicera xylosteum |
Ab. Mitte Juli |
|
Roter Hartriegel |
Cornus sanguinea |
September-Oktober |
|
Himbeere |
Rubus idaeus |
Anfang Juli bis Mitte August |
|
Brombeere |
Rubus fruticosus |
Ab. August |
|
Erdbeere |
Fragaria vesca |
Mai-Oktober |
|
Heidelbeere |
Vaccinium myrtillus |
Juli-September |
(Ab. 39)
Insgesamt wurden 25 Nachtbeobachtungen an 6 verschiedenen Bauen während knapp 38 Stunden durchgeführt (siehe Tab. 24, Anhang 2). Die Dauer der Anstände varierte entsprechend der Aktivität der Dachse und je nach Wetterbedingungen zwischen 45 Minuten und 2h15 Stunden. Die Tab. 12 gibt eine Zusammenstellung der wichtigsten Resultate.
Gleichzeitig wurden nie mehr als 3 Tiere beobachtet, und auch dies nur an einem einzigen Bau (Brüggen). Im Seeholz und in Wolfacherhölzli, wo ich nur 2 bzw. 1 einzigen Dachs(e) sah, war die Gesamtzahl an Tieren vor den Nachtbeobachtungen höher. In Wolfacherhölzli sind tatsächlich 2 adulte Dachse überfahren worden und im Seeholz ist 1 adultes Tier vom Jagdaufseher geschossen worden (Karin Hindenlang, pers. Mitt.). Im Seleger Moor zeigte sich nur ein einziges Tier am Hauptbau, aber es ist zu vermuten, dass andere Tiere in einem oder mehreren (?) der zahlreichen Nebenbauen wohnten. In Hinter Jungalbis sah ich kein einziges Tier, obwohl frische Dachs-Spuren vor einer Röhre mehrmals vorhanden waren. Möglicherweise diente dieser Nebenbau (?) als nächtlicher Aufenthaltsort für die im Seeholz wohnenden Tiere. Mitte Juli beobachtete ich im Rorholz 2 adulte Tiere. Da ich aber an den drei vorhergehenden Abenden in Brüggen keine Tiere mehr gesehen hatte, und da die von mir vor den Hauptröhren eingerichteten Holzstücke gar nicht bewegt wurden, vermute ich aber, dass diese Tiere ins Rorholz umgezogen waren (Ende Mai sah ich im Rorholz keine Tiere !).
Tab. 12 :
Anzahl Nachtbeobachtungen an 6 verschiedenen Bauen mit Angabe der Anzahl beo-bachteten Tiere, Adulte und Junge. Ziffern in eckigen Klammern wurden im Total nicht zusammen-gezählt, da die Tiere im Rohrholz wahrscheinlich die gleichen als in Brüggen waren. Ziffern in üblichen Klammern schliessen die im Jahre 1997 geschossenen oder überfahrenen Tiere ein.|
Bauname |
# Beobachtungen |
# Tiere |
# Adulte |
# Junge |
|
Rorholz |
6 |
[2] |
[2] |
[0] |
|
Brüggen 1 |
7 |
3 |
2 |
1 |
|
Wolfacherhölzli 1 |
3 |
1 (3) |
1 (3) |
0 |
|
Hinter Jungalbis 1 |
4 |
0 |
0 |
0 |
|
Seleger Moor |
2 |
1 |
1 |
0 |
|
Seeholz 1 |
3 |
2 (3) |
1 (2) |
1 |
|
Total |
25 |
7 (10) |
5 (8) |
2 |

© Georges Veya, 1996
Probleme bei der Bestimmung der Baue und Latrinen
Bevor ich meine Resultate kommentiere und sie z. T. mit anderen in Europa durchgeführten Arbeiten vergleiche, möchte ich noch einige Bemerkungen über die Bestimmung der Baue und Latrinen machen. Die Zuverlässigkeit der angewandten "Methoden" kann ja auch einen Einfluss auf die Resultate ausüben.
Die Präsenz einer Tierart in einem Bau kann nur zu 100 % bewiesen werden, wenn man Nachtbeobachtungen durchführt. Solche wurden aber nur an 6 Bauen gemacht. Die meisten Bestimmungen führte ich durch das Suchen von charakteristischen Spuren um die Baue durch. Haare wurden bei gewissenhaftem Suchen sehr oft vor den Röhren gefunden, während Trittsiegel vor allem in weichen Böden oder auf frisch gegrabenen Erdhaufen gefunden bzw. bei Regentagen (eigentlich Regennächten !) gemacht wurden und demzufolge nicht systematisch beobachtet wurden. Wie dem auch immer sei können die Haare von früheren Bewohnern und die Fährten von vor dem Bau vorbeigewanderten Tiere stammen, sodass Bestimmungsfehler mit solchen gewöhnlich "sicheren" Kennzeichen leider möglich sind.
Verhaltensbedingte Spuren wurden auch nicht als zuverlässige Bestimmungs-faktoren betrachtet, da sowohl Dachse als auch Füchse eine gewisse Variation bzw. Anpassung in ihren Lebensgewohnheiten zeigen können. Zum Beispiel ein Bau mit Röhren, vor denen nur wenige Erdaushübe vorhanden sind, wird nicht unbedingt von einem Fuchs bewohnt, sondern trotzdem von einem Dachs. Erstens kann das an der Bodenbeschaffenheit liegen, da Dachse nicht immer wie "verrückt" graben können. Weitere Faktoren können aber für die Anlage des Dachses in diesem Gebiet positiv wirken. Zweitens kann es sich um einen Nebenbau handeln, der sehr oft wenige Röhren hat und kleiner (d. h. es wird von den Dachsen auch weniger gegraben) als ein Hauptbau ist, weil er nur temporär bewohnt wird. Relativ grosse Erdhaufen werden aber manchmal auch vor Fuchsbauen gefunden, vor allem wenn der Boden leicht grabbar ist. Ein solcher Haufen wurde z. B. in meinem Gebiet vor dem Fuchsbau Schürenmooshölzli 1 beobachtet, wo der Boden torfig ist. Füchse sind ja schlechtere Gräber als Dachse, dies bedeutet aber nicht, dass sie eine wenig Energie fordernde Arbeit nicht leisten können ! Ein weiteres Beispiel betrifft die Rinnen, die von den Dachsen durch das wiederholte Graben vor den Bauen gebildet werden. Es wird von mehreren Autoren erwähnt (Kruuk 1978a, Monnier 1993), dass Dachse vor allem im Frühjahr (Präsenz der Jungen) und im Herbst (Putzen und Einrichtung des Baues für die Winterperiode) graben. Dies kann vielleicht erklären, wieso frische deutliche Rinnen nicht immer vor Dachsbauen gefunden werden. Schlussendlich ist noch zu erwähnen, dass Füchse sich oft Dachsbaue aneignen, wenn sie verlassen werden, oder Dachs-Nebenbaue temporär bewohnen, wenn diese frei sind und zur Verfügung stehen (siehe z. B. Lafontaine 1983, Bourand 1989, Neal & Cheeseman 1996, Labhardt 1996). Die "Topographie" des Baues allein könnte in solchen Fällen die Präsenz von Dachsen vortäuschen. Diese Beispiele haben mich zu Vorsicht angeregt, und so wurde immer nach der gleichzeitigen Präsenz mehrerer Spuren gesucht, um die Zuverlässigkeit der Bestimmung zu erhöhen. Fehler sind aber vielleicht aufgetreten.
Ein Problem stellte sich auch bei der Erkennung der Latrinen. Obwohl verschiedene Autoren eine eindeutige Unterscheidung zwischen Kotgruben und Nah-rungslöchern machen (siehe z. B. Anderegg & Meier 1978, Bourand 1989), schien mir dies nicht so einfach. Vor allem wenn Latrinen seit langem nicht mehr benutzt werden, ist der Unterschied zu alten Nahrungslöchern sehr schwierig zu sehen. Zudem werden nach persönlichen Beobachtungen oft Nahrungslöcher in der Nähe von (benutzten) Latrinen gemacht; so ist es schwierig festzustellen, welche und wieviele Löcher für die Kotabsetzung resp. für die Nahrungssuche gegraben wurden. Vermutet wird auch, dass Dachse vereinzelte Nahrungslöcher als Kotgruben benutzen können. Nach Karin Hindenlang (pers. Mitt.) könnten Dachse sogar in relativ alten Kotgruben Nahrung suchen, da sich viele Insektenlarven (v. a. Dipteren und Käfer) in den Dachslosungen entwickeln können.
Anzahl, Dichte und Verteilung der Baue
Im Untersuchungsgebiet wurden 19 Baue gefunden, die von Dachsen bewohnt bzw. Angelegt waren. Die entsprechende Dichte von 1.19 Bauen/100 ha ist viel höher als der Wert von Graf (1988, zitiert in Good 1997) in der Nähe von Bern (0.42/100 ha) und jener von Monnier (1993) im Kanton Neuenburg (0-0.22 pro 100 ha). In ex-Tschechien fanden Pelikan und Vackar (1978) ebenfalls eine kleine Dichte von 0.18 Baue/100 ha. In Frankreich sehen die Daten sehr ähnlich aus : 0.16/100 ha im Orléans-Wald (Bon & Thevenin 1975, zitiert in Bourand 1989), 0.18/100 ha im Chizé-Wald (Mouchès 1981) und 0.07-0.74/100 ha im Finistère (Lafontaine 1983). Jedoch ist die Baudichte in der offenen Kulturlandschaft des Knonaueramtes viel kleiner als die Werte, die in Grossbritannien gefunden wurden. Eine Zusammenstellung von Cresswell et al. (1990) lieferte Zahlen zwischen 0 und 26 Baue/100 ha in verschiedenen britischen Regionen. Clements et al. (1988) denken, dass 10 Baue pro 100 ha eine mittlere Baudichte darstellt. Die Dichte aller gefundenen Baue im Knonaueramt (2.69/100 ha) ist ebenfalls viel kleiner als die im Sihlwald von Good (1997) beobachtete Dichte (12.30/100 ha). Wahrscheinlich stellt dieser Mosaikwald ein sehr günstiges Habitat für Dachse und Füchse dar.
Nach der Anzahl Röhren und verschiedenen im Feld gemachten Beobachtungen konnte ich 6 Dachs-Hauptbaue und 13 Dachs-Nebenbaue erkennen. Die mittlere Distanz zwischen zwei Hauptbauen betrug 1'485 m. Diese ist viel grösser als der in Wytham von Kruuk (1978a) erhaltene Wert (300 m) oder derjenige von Good (1997) im Sihlwald (311 m). Dabei ist aber zu beachten, dass beide Autoren Baue als Hauptbaue betrachtet hatten, die mehr als 2 Röhren hatten (rein definitionsgemäss). Im meinem Gebiet hatten dagegen mehrere Nebenbaue mehr als 2 Röhren. Die Daten von Monnier (1993) in Neuenburg (1’145 m) scheinen mehr mit meinem Wert übereinzustimmen. Solche Unterschiede in der Verteilung der Hauptbaue sind ohne Zweifel auf Unterschiede in den Landschaftstypen zurückzuführen. Der Sihlwald (10 km2) und der Wytham-Wald (3.91 km2) sind grosse zusammenhängende, nur wenig unterbrochene deckungsreiche Gebiete, während das Knonaueramt und gewisse Teile des Kantons Neuenburg aus fragmentierten Wäldchen bestehen. Jedoch zeigen meine Resultate, dass die Dachse diese kleine Wälder selektieren. Offenbar spielen aber weitere Faktoren einen entscheidenden Einfluss auf die mehr oder weniger grosse Benutzung der Waldfläche. An zwei Orten z. B. (Seleger Moor und Gom) waren die Baue besonders geklumpt (10 bzw. 9 Baue). In Arbach (feuchter Boden) und Buecholz/Wislig (v.a. dicht gepflanzten Weisstannen) gab es gar keinen einzigen Bau !
Baumerkmale
Die Menge des Erdmaterials, welches die Dachse im Laufe der Zeit herausgegraben haben, vermittelt den besten Eindruck der Grösse (Rauminhalt) der Baue (Bock 1986, 1987). Da aber die Tiere die Erdhaufen durch das kontinuierliche (oder mindestens periodische) Betreten langsam aber sicher zusammendrücken, stellt sich eine visuelle Abschätzung des ausgegrabenen Erdmaterials als sehr schwierig und ungenau heraus. Da eine quantitative Messung zu aufwendig und zeitraubend ist, und dabei die Dachse unnötig stört, wurde die Grösse der Dachs- und Fuchsbaue in meiner Arbeit durch die Anzahl Röhren und die Baufläche (Ausdehnung Länge x Ausdehnung Breite) gewonnen.
Dachsbaue hatten zwischen 1 und 34 Röhren, mit einem Durschnitt von 9.74 (n = 19). Diese Daten stimmen gut mit den in anderen Ländern gefundenen Werten überein. In Belgien fanden Anrys und Libois (1983) 1 bis 38 Röhren pro Dachsbau, mit einem Mittelwert von 13.30 (n = 107). Kruuk (1978a) beobachtete Hauptbaue mit 3 bis 21 Röhren, und Nebenbaue mit 1-2 Röhren. Alle Baue zusammen ergaben einen Mittelwert von 10.5 Röhren pro Bau. Extremere Werte sind jedoch möglich. van Wijngaarden & van de Peppel (1964, zitiert in Lafontaine 1983) beschreiben z. B. einen Bau in Holland, der mehr als 100 Röhren besass uns sich über mehr als 1 ha ausbreitete. Good (1997) fand nur einen Mittelwert von 2.26 Röhren pro Bau (n = 123) im Sihlwald. Ein möglicher Grund dafür ist, dass Fuchs- und Dachsbaue nicht unterschieden werden konnten. Eine besonders gute Übereinstimmung wurde zwischen meinen Resultaten und denjenigen von Eiberle (1975) bzw. Monnier (1993) gefunden (Tab. 13).
Tab. 13 :
Vergleich der Anzahl Röhren für verschiedene Bau-Typen im Knonaueramt (ZH) mit derjenigen im Reppischtal (ZH, Eiberle 1975) und im Kanton Neuenburg (Monnier 1993).|
|
Knonaueramt |
Reppischtal |
Neuenburg |
|||||||||||
|
Kategorie |
n |
min |
max |
|
n |
min |
max |
|
n |
min |
max |
|
||
|
Fuchs |
22 |
1 |
7 |
2.41 |
190 |
1 |
18 |
2.28 |
10 |
1 |
7 |
3.00 |
||
|
Dachs |
9 |
1 |
10 |
4.11 |
7 |
8.4 |
29 |
? |
? |
7.17 |
||||
|
Dachs+Fuchs |
10 |
1 |
34 |
14.80 |
5 |
14.80 |
37 |
? |
? |
12.37 |
||||
|
Dachs gesamt |
19 |
1 |
34 |
9.74 |
12 |
11.06 |
10 |
2 |
23 |
8.29 |
||||
Weiter betrachtete ich die Ausdehnung der Baue, indem ich jeweils die Distanz zwischen den zwei entferntesten Röhren mass, und dies sowohl für die Länge als auch für die Breite. Diese Methode wurde schon von Roper (1992) und von Monnier (1993) angewendet, um die Fläche der Baue zu berechnen. Im Knonaueramt betrug die mittlere Baufläche 49.6 m2 für Fuchsbaue, 296 m2 für Dachsbaue und 567.5 m2 für Baue, wo beide Arten vorhanden waren. Diese Ergebnisse sind ein wenig grösser als diejenigen von Bourand (1989), der Flächen zwischen 100 und 300 m2 fand. Monnier (1993) erwähnt Werte zwischen 3 und 600 m2, mit einem Durschnitt von 154.57 m2 (n = 30). Roper (1992) fand seinerseits einen Mittelwert von 197.68 m2.
Rolle der verschiedenen Habitatparameter
Die Rolle der Habitatparameter für die Anlage von Bauen im Knonaueramt kann nicht ohne Vorbehalt interpretiert werden, und dies mit verschiedenen Gründen :
Jedoch möchte ich hier die wichtigsten Ergebnisse aufgrund von anderen ähnlichen in Europa durchgeführten Untersuchungen diskutieren.
Geographie / Topologie
Die Baue entdeckte ich zwischen 526 und 736 m Höhe ü. M., was gut mit dem Angebot übereinstimmt (524 m bzw. 741 m ü. M. für die zwei extremen Höhenpunkten im Gebiet). Nach Graf (1995) sind aber Dachse über die ganze Schweiz bis über 2000 m verbreitet, sodass die Anlage der Baue unter dieser Höhe wahrscheinlich von anderen Faktoren limitiert wird, wie z. B. die Abwesenheit von Wald, Wiesen und landwirtschaftlich gebauten Flächen oder die Bodentypen bzw. -beschaffenheiten. In Grossbritanien werden die meisten Baue zwischen 100 m und 200 m ü. M. gefunden (Neal 1986). Der Autor erklärt diese Tatsache dadurch, dass die Regionen unter 100 m ü. M. mehr besiedelt und intensiver landwirtschaftlich genutzt werden. Über 200 m ü. M. werden die Tiere weniger gestört, aber die Nahrung ist schwieriger erreichbar.
60 % der Baue waren an süd- oder westexponierten Hängen angelegt und nur 12 % gegen Nord oder Ost. Hier scheinen die Tiere selektiv zu sein, wie es auch andere Studien zeigen (Tab. 14), obwohl die lokale Topographie (d. h. das "Angebot") zu grossen Unterschieden führen kann. Möglicherweise kann auch die Höhe ü. M. einen Einfluss spielen, weil sich die klimatischen Bedingungen entlang dem Höhengradient ändern. In Belgien fanden z. B. Anrys und Libois (1983) in den höheren Regionen (Haute-Ardenne) 43 % der Baue an südexponierten Hängen, gegenüber nur 20 % in den tieferen, milderen Regionen.
Tab. 14 :
Vergleich der Exposition der Baue im Knonaueramt (ZH) mit derjenigen im Kanton Neuenburg (Monnier 1993), im Kanton Genf (Dunand 1981), in Belgien (Anrys & Libois 1983) und in Essex (Grossbritannien, Skinner et al. 1991).|
Exposition |
Knonaueramt (n = 43) |
Neuenburg (n = 38) |
Genf (n = 27) |
Belgien (n = 107) |
Essex (n = 497) |
|
Nord |
6.98 |
7.69 |
17.86 |
16.80 |
18.61 |
|
Ost |
4.65 |
35.90 |
7.14 |
20.60 |
23.54 |
|
Süd |
37.21 |
44.87 |
10.72 |
34.60 |
29.07 |
|
West |
23.26 |
11.54 |
32.14 |
20.60 |
28.78 |
|
Ebene |
27.91 |
0.00 |
32.14 |
7.40 |
0.00 |
Der grösste Teil der Baue wurde an wenig geneigten (44 %) bis steilen (35 %) Hängen gefunden, während die letzten 21 % an ebenen Standorten angelegt waren (d. h. wo die Röhren keine festgelegte Exposition zeigten). Auch in England wird die Mehrheit der Baue in Hängen gegraben. Neal (1986) gibt mehrere mögliche Gründe dazu :
Erleichterung :
Vorteile :
Vom letzten erwähnten Vorteil könnten aber die Tiere im Knonaueramt wahrscheinlich (noch) nicht profitieren, da sich 51 % der Baue an flachen Hängen befanden und solche "Bunker-Architektur" nur selten besassen. "Natürliche" konkave Hänge wurden übrigens gemieden (nur 7 %).
Geologie / Pedologie
Mehrere Untersuchungen haben gezeigt, dass der Boden oft eine wichtige Rolle für die Anlage der Baue spielt (Dunwell & Killingley 1969; Kruuk 1978a; Bock 1988a, 1988b). Dachse scheinen gut drainierte, leicht grabbare Böden zu bevorzugen, die keine Zusammenbruch-Gefahr darstellen. Diese Befunde stimmen mit meinen Beobachtungen im Knonaueramt gut überein.
Habitat / Vegetation
Die Baue fand ich entweder in Misch- (77 %) oder Nadelwäldern (23 %), während die offenen Gebiete gemieden wurden. Diese Beobachtung wird durch französische Untersuchungen unterstützt (Lafontaine 1983, Bourand 1989), die zeigen, dass Dachsbaue nur selten in offenen Gebieten angelegt werden. Studien in der Schweiz (Monnier 1993, Graf et. al. 1996) ergaben ähnliche Resultate. Neben die Tatsache, dass offene Gebiete den Tieren nur wenig Deckung bieten, erklärt Graf (1995), dass sich die Baue in Wäldern und Hecken befinden, « da der Mensch solche im Kulturland meist vernichtet ».
In Grossbritannien führt die Mammal Society eine regelmässige Zählung und Habitatanalyse von Dachsbauen (The National Badger Sett Survey) über das ganze britische Gebiet durch (Clements et al. 1988, Neal & Cheeseman 1996), um die ökologischen Ansprüche dieser Tierart besser zu erfassen. Ihre Auswertungen (Abb. 40) zeigen, dass der Dachs jedoch ein breiteres Spektrum von Habitaten nutzen kann, was sofort auf seine grosse Anpassungsfähigkeit hindeutet. Obwohl mehr als die Hälfte der Baue in Wäldern und Baumgruppen angelegt werden, können andere in Hecken, Buschdickichten oder – im Kontrast zu meinen Resultaten – sogar in offenen Feldern (8.4 %) angetroffen werden. Auch beim Bau seiner Höhlen kann der Dachs vom Menschen profitieren, zum Beispiel an Bahndämmen und unter Gebäuden (Skinner et al. 1991).
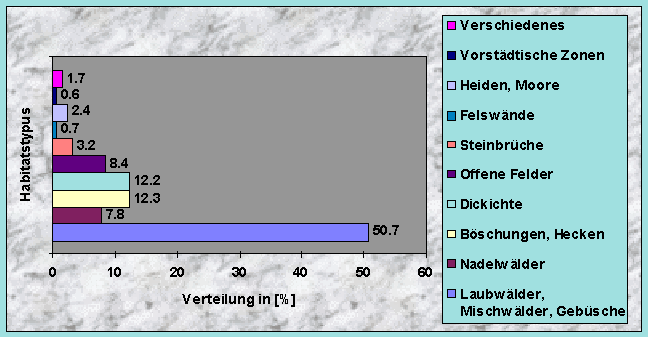
Abb. 40 :
Habitatwahl des europaïschen Dachses (Meles meles) für die Anlage von Bauen (n = 23'228) in Grossbritannien (England, Schottland, Wales). [Die Daten stammen aus Neal & Cheeseman (1996).]Der Mischungsgrad um die Baue bestand in 49 % der Fälle aus 51-90 % Nadelholz, manchmal aber aus fast reinem Laubholz (30 %). Weisstanne (51 %) und Buche (40 %) waren die beiden häufigsten Baumarten. Diese Ergebnisse sind hier wieder in guten Übereinstimmung mit anderen Studien, wo Dachsbaue nur selten in reinen Nadelwäldern angelegt wurden (siehe auch Abb. 40).
Der Deckungsgrad der Baumschicht in der Nähe der Baue war immer sehr dicht (79 % der Baue), während die Strauch- und Krautschichten nur selten mehr als 50 % der Probeflächen deckten. Diese Resultate sind im Wiederspruch mit denjenigen der Hauptkomponenten-Analyse, die herausstellen, dass ein hoher Deckungsgrad der Baumschicht negativ, ein hoher Deckungsgrad der Strauch- bzw. Krautschicht dagegen positiv auf die Anlage der Baue wirkt. Leider ist aber nicht klar, ob dies effektiv so ist, oder ob die Resultate durch die kleine Datenmenge bzw. die grosse Anzahl Habitatvariablen "verfälscht" worden sind.
"Ökologische Lage"
Wider alles Erwarten waren mehr als die Hälfte der Baue weniger als 50 m vom Waldrand (56 %) und vom nächsten Weg (70 %) entfernt. Da die Wälder im Knonaueramt oft genügend breit sind, um die Baue weiter entfernt anzulegen, ist zu vermuten, dass die Bedingungen nur in der Nähe der Waldränder günstig waren (Hang, Boden,...), oder dass die Tiere so keine Störung empfinden (Wege werden ja nachts von den Menschen weniger benutzt). Die Nähe des Waldrandes hat auch ihre Vorteile, indem die Tiere die Nahrungsplätze (Wiesen, Äcker) schneller erreichen können. Baue waren dagegen häufiger mehr als 100 m von der nächsten Strasse (79 %) und vom nächsten Wasserlauf (67 %) angelegt. Diese Resultate sind schwieriger zu interpretieren, da die Dichte der Strassen- und Gewaessernetze einen grossen Einfluss ausüben kann. Sicher ist aber, dass Strassen eine grössere Störungsquelle als Wege darstellen, und dass Dachse nicht unbedingt auf Wasser angewiesen sind (Wasser wird grösstenteils mit der Nahrung aufgenommen).
Bezüglich der Nähe von Getreide-Äckern waren im Mittel nur die Maisfelder in einer "vernünftigen" Distanz der Baue zu finden (81 % £ 250 m). Dagegen war die Entfernung bis zu den nächsten Weizen- (47 %), Gersten- (56%) und Haferfeldern (93 %) mehrheitlich länger als 250 m. Diese Resultate sind "natürlich" direkt mit der abnehmenden Gesamtfläche dieser Getreide-Arten verbunden (vgl. Tab. 8). Obstgärten lagen je nach Fall sehr nah bis sehr weit von den jeweiligen Baustandorten. Wichtig ist aber, dass ich in meiner Arbeit keine Unterschiede zwischen Feldern mit 1 oder 2 Obstbäumen und solchen mit 20 Bäumen machte. So spielt das Verhältnis Entfernung/Anzahl Obstbäume auch eine grosse Rolle, und nicht nur die Entfernung allein. Bezüglich der geschnittenen Wiesen waren diese von Juni bis August immer sehr nah zu finden (79 % / 88 % / 100 % £ 250 m), was natürlich einen Vorteil für die Suche von Regenwürmern darstellt !
Wieso wurden so wenig Latrinen gefunden ?
Im Knonaueramt fand ich nur 11 Latrinen – 7 davon im Seleger Moor –, was mir leider keine Möglichkeit gab, eine statistische Auswertung durchzuführen. Ich sehe verschiedene mögliche Gründe, wieso so wenig Latrinen gefunden wurden :
Bezüglich der Merkmale der gefundenen Latrinen hatten diese zwischen 1 und 15 Gruben, mit einem Durchschnitt von 5.60. Good (1997) fand im Sihlwald ähnliche Daten : Latrinen hatten im Mittel 3.50 Gruben, mit Extremwerten von 1 bis 20.
Als Bestätigung verschiedener Studien (Kruuk 1978a, Good 1997), waren auch die meisten Latrinen entweder um die Baue oder in der Nähe von Landmarken (Wegen, Wasserläufen, Waldrändern). Natürlich muss man auch beachten, dass die Latrinen in den offenen Gebieten gezielt entlang solchen Landmarken abgesucht worden sind !
Räumliche und zeitliche Verteilung der Wiesen und Weiden
Beim Dauergrünland ist die pflanzliche Artenzusammensetzung für die Dachse kaum von Beudeutung. Wiesen (periodisch gemäht) und Weiden (beweidet) sind nicht als pflanzliche, wohl aber als tierische Nahrungsquellen interessant. Vor allem Regenwürmer spielen in vielen Studien über die Nahrungsökologie des europäischen Dachses eine wichtige Rolle (Notini 1948, Andersen 1955, Skoog 1970, alle zitiert in Neal 1986). In gewissen Regionen Grossbritanniens können sich die Dachse sogar auf Regenwürmer spezialisieren (Kruuk 1978b; Kruuk & Parish 1981, 1982), indem diese stärker als ihrem Angebot entsprechend genutzt werden. Wie aber mehrere Studien zeigten (Kruuk & de Kock 1981, Mouchès 1981, Harris 1984, Henry 1984, Lambert 1990), können diese Beobachtungen nicht verallgemeinert werden. Regenwürmer können zwar als Basisnahrung des Dachses bezeichnet werden, aber sein Speisezettel wird je nach Region bzw. Jahreszeit durch weitere Nahrungstypen ergänzt bzw. ersetzt.
Wie Kruuk et al. (1979) gezeigt haben, können nachts an der Oberfläche Nahrung suchende Würmer nur in kurzem Gras in genügender Menge erbeutet werden. Deswegen wurde im Gebiet den geschnittenenen Wiesen (Grashöhe < 10 cm) ein wichtiger Stellenwert eingeräumt. Diese werden ja von Juni bis August immer wieder an anderen Orten gefunden, was natürlich die "Aufgabe" der Dachse nicht erleichtert ! Im August sollten günstigere Bedingungen vorhanden sein, da die Gesamtfläche an geschnittenen Wiesen sowohl im gesamten Untersuchungsgebiet als auch um die Baue stark vergrössert wurde. Es ist aber wichtig zu beachten, dass Wiesen mit kurzem Gras (10 cm < Grashöhe < 20 cm) und Weiden ebenfalls als Nahrungsplätze dienen können, wobei in einer weniger signifikanten Weise (Grashöhe bzw. Zäune oder Störung durch das Vieh). Auch im Wald können Dachse Regenwürmer finden (Hofer 1988, Kruuk 1989, Good 1997).
Räumliche und zeitliche Verfügbarkeit der Getreide-Arten
Wie schon erwähnt werden Getreide vom Dachs v. a. im Milchstadium gefressen (siehe z. B. Lafontaine 1983, Bourand 1989). Bedingt durch die unterschiedlichen Reifeperioden der verschiedenen Getreide-Arten, war das Angebot an Getreiden von Mitte Juni bis Ende August superabundant. Das Gesamtangebot für die drei Aufnahme-Perioden war im Juli und August ungefähr gleich gross (flächenmässig), aber fast doppelt so gross als im Juni. Wie erwartet stellte Mais den grössten Teil (38.48 %) aller Getreide-Aecker dar, was der Vorliebe des Dachses für die Maiskolben natürlich nicht entgegenkommt. Wichtig ist aber zu beachten, dass diese Ressourcen anfangs Juni, Juli und August kurz (7-10 Tage) nicht verfügbar waren. Deswegen ist es für die Tiere wichtig, dass weitere Nahrungsquellen während diesen "Engpässen" vorhanden sind.
Die räumliche Verteilung der Äcker wurde keinen Veränderungen unterworfen, sodass die Dachse die Lage dieser Nahrungsplätze wahrscheinlich schnell lokalisieren können. Die grössten Variationen sollten vor allem von Jahr zu Jahr erscheinen, da die Getreide-Arten jeweils an anderen Orten ausgesät werden.
Räumliches und zeitliches Obstangebot
Mehrere Untersuchungen in Zentral- und Süd-Europa (Rahm & Born 1976; Kruuk & De Kock 1981; Kistler & Misteli 1984; Stocker & Lüps 1984; Lüps et al. 1987, 1991; Monnier 1993; Roper & Lüps 1995) haben gezeigt, dass der Dachs saisonal und je nach den jeweiligen Habitatverhältnissen ein breites Spektrum bzw. eine grosse Menge von Früchten ausnutzen kann.
Im Untersuchungsgebiet standen vor allem Kirsch-, Apfel- und Birnbäume zur Verfügung. Einige Pflaumen- bzw. Zwetschgenbäume waren auch an gewissen Orten zu finden. Bedingt durch die speziellen Wetterbedingungen des Jahres 1997 waren die Kirschen Mitte Juni schon reif und am Boden bis Mitte Juli nur selten in bedeutender Menge verfügbar. Äpfel und Pflaumen/Zwetschgen waren dagegen im August ständig in "vernünftiger" Anzahl zu finden. Allgemein kann man aber nicht sagen, dass das Angebot dieses Jahr optimal war.
Die 259 Flächen, die Obstbäumen enthielten, befanden sich vor allem in der Nähe von Dörfern bzw. Bauernhöfen. Dies könnte für die Nahrungsbeschaffung ein Hindernis darstellen. Zwar nicht wegen der Präsenz der Menschen (daran haben sich die Dachse in den Landwirtschaftszonen wahrscheinlich gewöhnt), sondern weil die meisten Bauern einen bis mehrere Hunde besitzen. Da die Obstgärten von Jahr zu Jahr keine Ortsveränderungen unterworfen sind, sollte die Lokaliserung des Obstangebots kein Problem stellen. Dagegen spielen die jährlichen Wetterbedingungen wahrscheinlich eine grosse Rolle für die Nahrungsvoraussagbarkeit, indem die Früchte nicht immer zum gleichen Termim reif sind.
Während den Nachtbeobachtungen wurden nie mehr als 3 Tiere pro Bau gleichzeitig beobachtet. Junge sah ich nur zwei. Diese waren jeweils von 2 bzw. 1 Adult(en) begleitet. Die ermittelte Anzahl Tiere an den vershiedenen Bauen muss aber als ein Minimum betrachtet werden. Erstens wurden einige Individuen überfahren oder geschossen, und zweitens war die angewandte Methode nicht absolut zuverlässig. Wie von Kruuk (1978a) erwähnt, ist es sehr oft schwierig alle Eingänge gleichzeitig zu überwachen oder sie wegen der manchmal dichten Vegetation klar zu sehen. Gewisse Individuen können auch sehr spät ausgehen. Schlussendlich ist es auch schwierig zu wissen, welcher Anteil an Gruppenglieder sich in einem Bau an einem bestimmten Tag befindet. Da aber die Beobachtungen jeweils an mehreren Abenden durchgeführt wurden, scheinen mir meine Ergebnisse nicht so weit von der exakten Anzahl Tiere zu liegen.
4.4. Bilanz : Passen unsere Beobachtungen zu dem vorgeschlagenen Modell ?
Um zu prüfen, ob meine Daten bzw. Beobachtungen einer der zwei Situationen des getesteten Modells (siehe Tab. 1, Seite 6) entsprechen, möchte ich die einzelnen Punkte kurz durchgehen.
Nun ist aber zu beachten, dass gewisse "Bottleneck"-Perioden – je nach jährlichen bzw. saisonalen klimatischen Bedingungen – eine entscheidende Rolle spielen können. Dies einerseits in Bezug auf die Anzahl adulter Tiere, die im Streifgebiet leben können, und anderseits auf die Überlebenschancen der Jungen. Diese müssen ja lernen (z. T. mit ihrer Mutter), wie und wo man sich Nahrung beschaffen kann. Das "Wo" ist eben in solchen, vielen räumlichen und zeitlichen Veränderungen unterworfenen Gebieten, schwierig zu lernen. Wenn gerade ein Engpass während der früheren Lernstadien erscheint (z. B. Trockenheit im Sommer ® drastisches "Sinken" des Regenwurmangebots), dann ist zu vermuten, dass nur wenige – wenn nicht sogar keine – Jungen überleben würden. In diesem Sinne würde das Habitat eher suboptimal sein !
Schliesslich ist aber auch wichtig zu definieren, was optimal und suboptimal wirklich bedeuten. Je nach Betrachtungsweise könnten alle Habitate optimal oder suboptimal erscheinen. Nach meiner Meinung sollte ein Habitat für die Dachse optimal sein, wenn es innerhalb des von einem Tier aufgrund verschiedener Faktoren gewählten Streifgebiets ganzjährig Nahrungsressourcen für mehr als ein Tier bieten kann. In diesem Sinne würde also das Knonauer-Amt optimal sein.
Bilanz
Die hier beschriebenen "Parameter" [1-7] würden eher der "suboptimalen Situation" des Modells (vgl. Tab. 1) entsprechen. Probleme dabei sind dadurch gegeben, dass die Tiere nicht solitär leben, und dass das Habitat relativ optimale Bedingungen bietet, obwohl diese mit denjenigen in Grossbritannien gar nicht vergleichbar sind. Es ist zu vermuten, dass das Knonaueramt eine intermediäre Stellung zwischen den 2 vorgeschlagenen extremen Habitaten (A und Z) des Modells einnimmt, und deswegen sowohl Merkmale eines ganz suboptimalen Habitats (Parameter 2-6) als auch eines ganz optimalen Habitats (Parameter 1 und 7) vorzeigt bzw. hervorbringt. Obwohl dieses Modell gut miteinander korrelierte "Parameter" für die 2 betrachteten Situationen verbindet, muss es noch vervollständigt bzw. korrigiert werden.
Meine Beobachtungen im Untersuchungsgebiet und die durch die ausgiebige Literatur erhaltenen Kenntnisse haben mich schliesslich dazu geführt, eine Hypothese über den Mechanismus der Gruppenbildung bei Dachsen, sowie das Problem der Gruppenregulierung auszuarbeiten. Die sogenannte "Hypothese der Kritischen Energieschwelle" (HKES) stelle ich – in französischer Sprache – im Anhang 1 vor.
© Georges Veya, 1996
Zusammenfassung
Von Mitte April bis Mitte August 1997 wurde die Habitatwahl, das pflanzliche Nahrungsangebot sowie die soziale Organisation des Dachses (Meles meles) in einem Kulturland in der Nähe von Zürich (Knonaueramt, CH) untersucht. Ziel dieses Studium war einen Teil der Mechanismen zu verstehen, wie die Habitatstruktur und die Nahrungsverfügbarkeit im Untersuchungsgebiet die Sozialstruktur der Tiere beeinflussen bzw. bestimmen könnten.
Bei der Kartierung des Gebiets wurden 43 Baue gefunden; 19 davon waren von Dachsen bewohnt oder von diesen momentan gelassen. Die gesamte Dachsbaudichte im Knonaueramt betrug 1.19 Baue/100 ha. Die Baue waren in der Mehrheit weniger als 50 m vom Waldrand und vom nächsten Weg zu finden, dagegen mehr als 100 m von der nächsten Strasse und dem nächsten Wasserlauf entfernt. Mit Ausnahme der Maisfelder waren die Äcker grösstenteils mehr als 250 m von den Bauen entfernt. Obstbäume lagen vor allem in der Nähe von Dörfern und isolierten Bauernhäusern. Geschnittene Wiesen (Regenwürmer-Angebot !) standen dagegen von Juni bis August immer in der Nähe der Baustandorte zur Verfügung.
Im Gebiet wurden nur 11 benutzte Latrinen gefunden, was einer Dichte von 0.69 Latrine/100 ha entspricht. Mögliche Gründe für eine so kleine Anzahl werden analysiert. Latrinen wurden oft in der Nähe von Landmarken (Waldrändern, Wegen, Wasserläufen) bzw. Bauen gefunden.
Die gesammelten Daten und Informationen bei der Kartierung der Äcker, Wiesen und Weiden und während den periodischen Vegetationsaufnahmen deuten auf ein stark heterogenes Habitat für die Dachse hin. Die zeitliche und räumliche Verfügbarkeit der Nahrungsressourcen (Getreide, Obst, Regenwürmer) im Laufe des Jahres bzw. von Jahr zu Jahr ist schwierig vorauszusagen. Bedingt durch das breite Nahrungsspektrum sind die Dachse in diesem Landwirtschaftsgebiet wahrscheinlich Generalisten bzw. Opportunisten. Die grosse Entfernung der Hauptbaue und die weite Verteilung der reichen Nahrungsklumpen lässt aber vermuten, das sie grosse Streifgebiete brauchen, was zu einer kleinen Populationsdichte führt. Pro Bau wurden eben nur zwischen 1 und 3 Tieren beobachtet (und nie mehr als 1 Junges).
Alles in allem stellt aber das Knonaueramt ein optimales Habitat dar, in dem Sinn, dass es innerhalb des von einem Tier aufgrund verschiedener Faktoren gewählten Streifgebiets ganzjährig Nahrungsressourcen für mehr als ein Tier bieten kann.
Dank meinen Beobachtungen im Untersuchungsgebiet und den durch die Literatur erhaltenen Kenntnissen wurde eine Hypothese über den Mechanismus der Gruppenbildung bzw. -regulierung bei Dachsen ausgearbeitet und vorgestellt ("Hypothese der Kritischen Energieschwelle").
Résumé
De mi-avril à mi-août 1997, j’ai étudié le choix de l’habitat, l’offre alimentaire végétale ainsi que l’organisation sociale du Blaireau (Meles meles) dans une région agricole des environs de Zurich (Knonaueramt, CH). Le but de ce travail était de comprendre en partie, comment la structure de l’habitat et la disponibilité alimentaire dans le terrain d’étude pouvaient déterminer ou du moins influencer la structure sociale des animaux considérés.
43 terriers ont été trouvés lors de la cartographie de la zone d’étude; 19 d’entre eux étaient occupés par des blaireaux ou momentanément abandonnés par ceux-ci. La densité totale des terriers de blaireaux dans le Knonaueramt s’élevait à 1.19 terriers/100 ha. Les terriers se situaient en majorité à moins de 50 m de la lisière forestière et du chemin le plus proche. En revanche, la majorité d’entre eux étaient localisés à plus de 100 m de la route ou du cours d’eau la/le plus proche. A l’exception des champs de maïs, les cultures étaient en grande partie éloignées de plus de 250 m des terriers. Les arbres fruitiers étaient surtout situés aux abords des villages et des fermes isolées. Des prairies fauchées (offre en vers de terre !) étaient en revanche "disponibles" de juin à août à proximité des terriers.
11 latrines utilisées ont été trouvées dans le terrain d’étude, ce qui correspond à une densité de 0.69 latrine/100 ha. Les causes liées à la découverte d’une quantité aussi faible sont analysées. Les latrines étaient souvent situées à proximité de marques du paysage (lisières forestières, chemins, cours d’eau) ou de terriers.
Les données et les informations récoltées lors de la cartographie des cultures, des prairies et des pâturages et durant les contrôles périodiques de la végétation indiquent clairement que les blaireaux vivent dans un habitat fortement hétérogène. La disponibilité temporelle et spatiale des ressources alimentaires (céréales, fruits, vers de terre) au cours de l’année ou d’année en année est difficile à prévoir. Les blaireaux vivant dans cette région agricole sont probablement généralistes ou opportunistes, en raison du large spectre alimentaire disponible. L’éloignement des terriers principaux et la répartition des parcelles riches en nourriture laisse cependant supposer que ceux-ci utilisent de grands domaines vitaux, ce qui conduit à une petite densité de population. Je n’ai en effet observé que de 1 à 3 animaux par terriers (et jamais plus d’un jeune).
Tout bien considéré, le Knonaueramt représente cependant un habitat optimal, dans le sens où celui-ci peut offrir à l’intérieur du domaine vital défini par un blai-reau (selon divers critères) suffisamment de nourriture pour plus d’un individu, et ceci tout au long de l’année.
Grâce aux observations faites sur le terrain et aux informations fournies par l’abondante littérature, j’ai élaboré et présenté une hypothèse sur le mécanisme de la formation et de la régulation des groupes chez les blaireaux ("Hypothèse du Seuil Energétique Critique").
Summary
From mid-April to mid-August 1997, I studied the habitat choice, the food supply and the social organization of the Badger (Meles meles) in an agricultural area in the surroundings of Zurich (Knonaueramt, CH). The aim of this work was to understand a part of the mechanisms, how habitat structure and food availability in the study area could determine or at least influence the social structure of the animals.
43 setts were found during the cartography work of the area; 19 of them were occupied by badgers or temporarily leaved by them. The total density of badgers setts in the Knonaueramt was 1.19 setts/100 ha. Setts were found in most cases less than 50 m from the forest boundary and from the nearest path, but on the contrary more than 100 m from the nearest road and from the nearest water. Except corn fields, most of the land under cultivation was located at more than 250 m from sett sites. Fruit trees were especially situated near villages and isolated farmhouses. Cuted grassland (earthworms supply !) was on the contrary "available" from June to August near sett sites.
11 used latrines were found in the study area, what corresponds to a density of 0.69 latrine/100 ha. Possible explanations for such a little number are analysed. Latrines were often situated near conspicuous landmarks (forest boundaries, paths, water) or setts.
Data and informations collected by the cartography of arable land, grassland and pastures and during the periodic checking of the vegetation make clear that badgers live in a very heterogeneous habitat. Temporal and spatial availability of food ressources during the year or from year to year is difficult to foresee. Badgers living in this agricultural area are probably food generalists or opportunists, according to the availability of a large food spectrum. The distance between main setts and the distribution of the rich food patches let meanwhile suppose that they use large home ranges, which leeds to a little population density. I actually saw only 1 to 3 animals per sett (and never more than 1 cub).
All things considered, Knonaueramt meanwhile represents an optimal habitat, because the home range choosen by a badger according to varied criteria holds food for more than an animal, and this throughout the year.
Owing to my observations in the study area and the abundant informations of the literature, I elaborated and presented a hypothesis about the mechanism of group formation and regulation by Badgers ("Critical Energy Threshold Hypothesis").

© Georges Veya, 1996
 An dieser Stelle möchte ich meinen herz-lichen Dank allen Personen aussprechen, die mir bei der vorliegenden Arbeit in irgend-einer Weise unterstützt haben.
An dieser Stelle möchte ich meinen herz-lichen Dank allen Personen aussprechen, die mir bei der vorliegenden Arbeit in irgend-einer Weise unterstützt haben.
![]() Zuerst möchte ich Dr. Werner Suter danken, dass er sofort einverstanden war, meine Diplomarbeit zu betreuen. Auch für die Korrektur der zahlreichen Sprachfehler und für die leider unerfolgreiche gemeinsame Beobachtung im Seleger Moor möchte ich mich bedanken.
Zuerst möchte ich Dr. Werner Suter danken, dass er sofort einverstanden war, meine Diplomarbeit zu betreuen. Auch für die Korrektur der zahlreichen Sprachfehler und für die leider unerfolgreiche gemeinsame Beobachtung im Seleger Moor möchte ich mich bedanken.
![]() Mein innigster Dank gehört Karin Hindenlang, die meine Diplomarbeit von dem Forschungsplan bis zur Datenanalyse mit Interesse, Geduld und Freundschaft betreute. Ihre Erfahrung hat mir
Mein innigster Dank gehört Karin Hindenlang, die meine Diplomarbeit von dem Forschungsplan bis zur Datenanalyse mit Interesse, Geduld und Freundschaft betreute. Ihre Erfahrung hat mir
erlaubt, meine Arbeit besser zu orientieren, zu planen und folglich durchzuführen.
![]() Die Erstellung der Karten, die diese Arbeit begleiten, würde für mich ohne die Hilfe von Stephan Imfeld undenkbar gewesen. Dank seiner pädagogischen Fähigkeiten erlaubte er mir ein schnelles Einsteigen in die Benutzung des Digitalisierungsgeräts und der Computer-Anwendungen des Geographischen Instituts der Universität Zürich. Seine Freundlichkeit und jederzeitige Verfürgbarkeit flössen mir die grösste Achtung ein.
Die Erstellung der Karten, die diese Arbeit begleiten, würde für mich ohne die Hilfe von Stephan Imfeld undenkbar gewesen. Dank seiner pädagogischen Fähigkeiten erlaubte er mir ein schnelles Einsteigen in die Benutzung des Digitalisierungsgeräts und der Computer-Anwendungen des Geographischen Instituts der Universität Zürich. Seine Freundlichkeit und jederzeitige Verfürgbarkeit flössen mir die grösste Achtung ein.
![]() Furthermore, I would like to express my gratitude to Tatjana Good, who generously took of her precious time (she had diploma exams) to explain me the statistical analysis of her data.
Furthermore, I would like to express my gratitude to Tatjana Good, who generously took of her precious time (she had diploma exams) to explain me the statistical analysis of her data.
![]() Ce travail n’aurais pas eu la même dimension sans le coup de crayon magique de Georges Veya, qui a chaleureusement accepté de l’illustrer. Je lui suis extrêment reconnais-sant pour les nombreuses heures de travail passées à étudier la morphologie de l’animal, puis à exécuter les différentes "attitudes" que je lui avais demandées.
Ce travail n’aurais pas eu la même dimension sans le coup de crayon magique de Georges Veya, qui a chaleureusement accepté de l’illustrer. Je lui suis extrêment reconnais-sant pour les nombreuses heures de travail passées à étudier la morphologie de l’animal, puis à exécuter les différentes "attitudes" que je lui avais demandées.
![]() De sincères remerciements à mon oncle Bernard Chételat, qui m’a montré les différentes espèces de céréales de son domaine et m’a ainsi permis de déterminer rapidement les types de champs présents dans le Knonaueramt. Les informations fournies sur les périodes de semaille et de moisson m’ont également été très précieuses.
De sincères remerciements à mon oncle Bernard Chételat, qui m’a montré les différentes espèces de céréales de son domaine et m’a ainsi permis de déterminer rapidement les types de champs présents dans le Knonaueramt. Les informations fournies sur les périodes de semaille et de moisson m’ont également été très précieuses.
![]() Une attention particulière à Alessandro Salsetti, mon ami de toujours, qui a accepté d’imprimer mon travail de diplôme dans sa maison de production à Beverly Hills (ou du moins qu’il s’appropriera bientôt...).
Une attention particulière à Alessandro Salsetti, mon ami de toujours, qui a accepté d’imprimer mon travail de diplôme dans sa maison de production à Beverly Hills (ou du moins qu’il s’appropriera bientôt...).
![]() J’adresse un grand merci à mon amie Marie pour son inestimable présence à mes côtés, aussi bien sur le terrain (à vélo ou lors de plusieurs soirées d’observation) que dans les salles d’informatique de l’Université de Zurich (parfois jusqu’à très très tard le soir).
J’adresse un grand merci à mon amie Marie pour son inestimable présence à mes côtés, aussi bien sur le terrain (à vélo ou lors de plusieurs soirées d’observation) que dans les salles d’informatique de l’Université de Zurich (parfois jusqu’à très très tard le soir).
![]() Je ne saurais finalement oublier de remercier le Service des Bourses de la République et Canton du Jura pour son aide financière tout au long de mes études. Qu’il considère ce travail comme le fruit de son soutien.
Je ne saurais finalement oublier de remercier le Service des Bourses de la République et Canton du Jura pour son aide financière tout au long de mes études. Qu’il considère ce travail comme le fruit de son soutien.

Anderegg, R. & Meier, R. (1978). Dachs. Wildbiologie 1(2), Schweizerische Dokumentationsstelle für Wildforschung, 9 p.
Andersen, J. (1955). The food of the Danish badger (Meles meles danicus). Danish Review of Game Biology 3: 1-75.
Anrys, P. & Libois, R. M. (1983). Choix de l’habitat chez le blaireau européen, Meles meles en Belgique. Cahiers d’éthologie appliquée 3(1): 15-38.
Artois, M. (1989). Le Renard roux (Vulpes vulpes Linnaeus, 1758). In Artois, M. & Delattre, P. (éd.). Encyclopédie des carnivores de France. N° 3. Société Française pour l’Étude et la Protection des Mammifères, Nort sur Erdre, 90 p.
Bacon, P. J., Ball, F. G. & Blackwell, P. G. (1991a). Analysis of a model of group formation in a heterogeneous habitat. J. theor. Biol. 148: 433-444.
Bacon, P. J., Ball, F. G. & Blackwell, P. G. (1991b). A model for territory and group formation in a heterogeneous habitat. J. theor. Biol. 148: 445-468.
Blaser, H. (1975). Les renards et les blaireaux. Série « Comment vivent-ils ? », N° 3, Atlas visuels Payot, Lausanne, 64 p.
Bock, W. F. (1986). Kriterien zur Grössenbeurteilung der Baue des Dachses (Meles meles L.). Säugetierkundliche Mitteilungen 33: 227-234.
Bock, W. F. (1987). Die Lebensraumnutzung des Dachses (Meles meles), erste Ergebnisse aus dem Raum Berchtesgaden. In Das Bärenseminär, Forschungsbericht 11: 46-51. National Park Berchtesgaden.
Bock, W. F. (1988a). Untersuchungen zur Lage und zum Mikroklima von Dachsbauen (Meles meles). Z. Jagdwiss. 34: 141-152.
Bock, W. F. (1988b). Die Bedeutung des Untergrundes für die Grösse von Bauen des Dachses (Meles meles) am Beispiel zweier Gebiete Südostbayerns. Z. Säugetierk. 53: 349-357.
Bodeneignungskarte der Schweiz (1980). Bodeneignungskarte Zürich. 1:50'000. Blatt 225. Bundesamt für Raumplanung.
Bon, E. & Thevenin, J. P. (1975). Les blaireaux de forêt domaniale d’Orléans. Naturalistes d’Orléans 3, N° 15.
Bourand, M. (1989). Le blaireau (Meles meles). Mémoire CSTC. Syndicat des Chasseurs de France, Union Nationale des Fédérations des Chasseurs.
Braun-Blanquet, J. (1964). Pflanzensoziologie. Springer Verlag, Wien.
Caro, T. M. (1994). Cheetahs of the Serengeti Plains : Group Living in an Asocial Species. University of Chicago Press, Chicago.
Carr, G. M. & Macdonald, D. W. (1986). The sociality of solitary foragers : a model based on ressource dispersion. Anim. Behav. 34: 1540-1549.
Cheeseman, C. L., Cresswell, W. J., Harris, S. & Mallison, P. J. (1988). Comparison of dispersal and other movements in two badgers (Meles meles) populations. Mammal Rev. 18(1): 51-59.
Cheeseman, C. L., Jones, G. W., Gallagher, J. & Mallison, P. J. (1981). The population structure, density and prevalence of tuberculosis (Mycobacterium bovis) in badgers (Meles meles) from four areas in south-west England. J. appl. Ecol. 18(3): 795-804.
Cheeseman, C. L., Mallison, P. J., Ryan, J. & Wilesmith, J. W. (1987). Badger population dynamics in a high-density area. Symp. Zool. Soc. Lond. 58: 279-294.
Cheeseman, C. L., Wilesmith, J. W., Ryan, J. & Mallison, P. J. (1993). Recolonisation by badgers in Gloucestershire. In Hayden, T. J., (ed.). The badger. Dublin Royal Irish Academy, pp. 78-93.
Clements, E. D., Neal, E. G. & Yalden, D. W. (1988). The National Badger Sett Survey. Mammal Rev. 18(1): 1-9.
CLutton-Brock, T. H. & Harvey, P. H. (1977). Primate ecology and social organisation. J. Zool., Lond. 183: 1-39.
Cresswell, W. J. & Harris, S. (1988). Foraging behaviour and homerange utilization in a suburban Badger (Meles meles) population. Mammal Rev. 18(1): 37-49.
Cresswell, W. J., Harris, S. & Jefferies, D. J. (1990). The history, distribution, status and habitat requirements of the badger in Britain. Nature Conser-vancy Council, Peterborough.
Crook, J. H. (1964). The Evolution of social organisation and visual communication in weaver birds (Ploceinae). Behaviour Suppl. 10: 1-178.
Crook, J. H. & Gartlan, J. S. (1966). Evolution of primate societies. Nature 210: 1200-1203.
Déom, P. (1982). La Hulotte 27: 20-23.
Doncaster, C. P. & Macdonald, D. W. (1992). Optimum group size for defending heterogeneous distribution of resource : a model applied to red foxes, Vulpes vulpes, in Oxford city. J. theor. Biol. 159: 189-198.
Doncaster, C. P. & Woodroffe, R. B. (1993). Den site can determine shape and size of badger territories : implications for group living. Oikos 66: 88-93.
Ducquet, M. (1993). Glossaire d’écologie fondamentale. Collection 128. Nathan, Paris.
Dunand, F. (1981). Mustélidés du canton de Genève, bilan d’une étude (1978-1981).
Dunwell, M. R. & Killingley, A. (1969). The distribution of badger setts in relation to the geology of the Chilterns. J. Zool., Lond. 158: 204-208.
Eiberle, K. (1975). Zur Anlage und Benützung der Fuchsbaue im jagdlichen Versuchsrevier der ETH Zürich. Schweiz. Z. Forstwesen 126(1): 41-64.
Ferrari, N. & Fischer, C. (1996). Le blaireau (Meles meles) en Suisse. In Protéger les mammifères ! A quel prix ? Rapport du XVIIIème Colloque Francophone de Mammalogie, Société française pour l’étude et la protection des mammifères, Bourges, pp. 195-201.
Fischesser, B. & Dupuis-Tate, M.-F. (1996). Le guide illustré de l’écologie. Éditions de La Martinière & Cemagref Éditions, Paris.
Frame, L. H., Malcom, J. L., Frame, G. W. & Lawick, H. van (1980). Social organisation of african wild dogs (Lycaon pictus) on the Serengeti Plains, Tanzania 1967-1978. Z. Tierpsychol. 50: 225-249.
Gittleman, J. L. (1989). Carnivore group living : comparative trends. In Gittlemann, J. L. (ed.). Carnivore behaviour, ecology, and evolution. Chapman & Hall, London & Cornell University Press, New York., pp. 183-207.
Good, T. (1997). A habitat analysis of badger (Meles meles, L.) setts and latrines in Sihlwald (ZH), Switzerland. Diplomarbeit, Universität Zürich.
Graf, M. (1988). Die räumliche und zeitliche Habitatnutzung einer Dachspopulation am Gurten bei Bern. Dissertation, Universität Bern.
Graf, M. (1995). Meles meles. In Hausser, J. (Hrsg.). Säugetiere der Schweiz. Birkhäuser Verlag, Basel, pp. 395-399.
Graf, M., Wandeler, A. I. & Lüps, P. (1996). Die räumliche Habitatnutzung einer Dachspopulation (Meles meles L.) im schweizerischen Mittelland. Rev. Suisse Zool. 103(4): 835-850.
Hainard, R. (1987). Mammifères sauvages d’Europe. Tome 1. Delachaux et Niestlé, Neuchâtel et Paris, 334 p.
Hantke, R. (1967). Geologische Karte des Kanton Zürichs und seiner Nachbargebiete. In zwei Blättern 1:50'000. Kommissionsverlag Leeman, Zürich.
Hausser, J. (1995). Säugetiere der Schweiz. Birkhäuser Verlag, Basel, 502 p.
Harris, S. (1982). Activity patterns and habitat utilisation of badgers (Meles meles) in suburban Bristol : a radio tracking study. Symp. Zool. Soc. Lond. 49: 301-323.
Harris, S. (1984). Ecology of urban badgers Meles meles : distribution in Britain and habitat selection, persecution, food and damage in the city of Bristol. Biol. Conserv. 28: 349-375.
Harris, S. & Cresswell, W. J. (1987). Dynamics of a suburban badger (Meles meles) population. Symp. Zool. Soc. Lond. 58: 295-311.
Henry, C. (1984). Eco-éthologie de l’alimentation du blaireau européen (Meles meles L.) dans une forêt du centre de la France. Mammalia 48: 490-503.
Hindenlang, K. (1992). Analyse und Beurteilung der Landschaft im Kanton Zürich anhand der Verbreitung ausgewählter einheimischer Wildtierarten. Diplomarbeit, Universität Zürich.
Hofer, H. (1988). Variation in resource presence : utilization and reproductive succes within a population of European badgers (Meles meles). Mammal Rev. 18(1): 25-36.
Immelmann, K. (1990). Dictionnaire de l’éthologie. Pierre Mardaga, Lièges-Bruxelles.
Kistler, P. & Misteli, F. (1984). Oekologische Untersuchungen über das Nahrungsangebot und dessen Nutzung durch den europaeischen Dachs (Meles meles L.) im Gebiet des Gurten bei Bern. Lizentiatsarbeit, Universität Bern.
Krebs, J. R. & Davies, N. B. (Hrsg.) (1981). Oeko-Ethologie. Pareys Studientexte 28. Paul Parey, Berlin.
Kruuk, H. (1972). The Spotted Hyena. Chicago University Press, Chicago.
Kruuk, H. (1975). Functional aspects of social hunting by carnivores. In Baerends, G., Beer, C. & Manning, A. (eds.). Function and Evolution in Behaviour. Clarendon Press, Oxford, pp. 119-141.
Kruuk, H. (1978a). Spatial organization and territorial behaviour of the European badger (Meles meles). J. Zool., Lond. 184(1): 1-20.
Kruuk, H. (1978b). Foraging and spatial organisation of the European badger, Meles meles L. Behav. Ecol. Sociobiol. 4: 75-89.
Kruuk, H. (1989). The social badger : ecology and behaviour of a group-living carnivore. Oxford University Press, Oxford.
Kruuk, H. & De Kock, L. (1981). Food and habitat of badgers (Meles meles L.) on Monte Baldo, northern Italy. Z. Säugetierk. 46(5): 295-301.
Kruuk, H. & Macdonald, D. W. (1985). Group territories of carnivores : empires and enclaves. In Sibly, R. M. & Smith, R. H. (eds.). Behavioural ecology : ecological consequences of adaptive behaviour. Symposia of the British Ecological Society 25, Blackwell Scientific Publications, Oxford, pp. 521-536.
Kruuk, H. & Parish, T. (1981). Feeding specialization of the European badger Meles meles in Scotland. J. Anim. Ecol. 50(3): 773-788.
Kruuk, H. & Parish T. (1982). Factors affecting population density, group size and territory size of the European badger, Meles meles. J. Zool., Lond. 196: 31-39.
Kruuk, H. & Parish T. (1987). Changes in the size of groups and ranges of the European badger (Meles meles L.) in an area in Scotland. J. Anim. Ecol. 56: 351-364.
Kruuk, H., Parish, T., Brown, C. A. J. & Carrera, J. (1979). The use of pasture by the European badger (Meles meles). J. appl. Ecol. 16(2): 453-459.
Labhardt, F. (1996). Der Rotfuchs. 2. Aufl. Paul Parey, Berlin.
Lafontaine, L. (1983). Blaireaux. Penn ar bed 113: 81-128.
Lambert, A. (1990). Alimentation du blaireau Eurasien (Meles meles) dans un écosytème forestier. Variations spatiales du régime et comportement de prédation. Gibier Faune sauvage 7: 21-37.
Lindström, E. (1980a). The red fox in a small game community of the south taiga region in Sweden. In Zimen, E. (ed.). The Red Fox. Junk, The Hague, pp. 177-184.
Lindström, E. (1986). Territory inheritance and the evolution of group-living in carnivores. Anim. Behav. 34: 1825-1835.
Lüps, P., Roper, T. J. & Stocker G. (1987). Stomach contents of badgers (Meles meles L.) in central Switzerland. Mammalia 51(4): 559-569.
Lüps, P., Roper, T. J. & Stocker G. (1991). Magen-Analysen bei Dachsen Meles meles aus der Umgebung Berns (1987-1989). Kl. Mitt. Naturhist. Mus. Bern 14: 1-10.
Macdonald, D. W. (1981). Ressource dispersion and the social organization of the red fox (Vulpes vulpes). In Chapman, J. A. & Pursley, D. (eds.). Proc. Worldwide Furbearer Conf. 1(2): 918-949. University of Maryland Press, Maryland.
Macdonald, D. W. (1983). The ecology of carnivore social behaviour. Nature 301: 379-384.
Martin-Franquelo, R. & Delibes, M. (1985). Ecology of the badger in Doñana, Mediterranean Spain. Unpublished paper presented at the IVth International Theriological Congress, Edmonton.
Meia, J.-S. (1994). Organisation sociale d’une population de renards (Vulpes vulpes) en milieu montagnard. Thèse de Doctorat, Université de Neuchâtel.
Monnier, M.-F. (1993). Le blaireau (Meles meles L.) dans le canton de Neuchâtel (Suisse). Travail de diplôme, Université de Neuchâtel.
Mouchès, A. (1981). Variations saisonnières du régime alimentaire chez le Blaireau européen Meles meles. Rev. Ecol. (Terre et Vie) 35: 183-194.
Neal, E. G. (1986). The Natural History of Badgers. Croom Helm, London & Sydney, 238 p.
Neal, E. G. & Cheeseman, C. (1996). Badgers. T & AD Poyser, London, 272 p.
Notini, G. (1948). Biologiska undersökningar över gravlingen, Meles meles. Svenska Jägareförbundet Meddelande 13: 1-256.
Packer, C & Pusey, A. E. (1982). Cooperation and competition within coalitions of male lions : kin selection or game theory ? Nature 296: 740-742.
Pelikan, J & Vackar, J. (1978). Densities and fluctuation in numbers of red fox, badger and pine marten in the "Bucin" forest. Folia Zool. 27(2): 289-303.
Pigozzi, G. (1987). Behavioural ecology of the European badger (Meles meles L.) : diet, food availability and use of space in the Maremma Natural Park, Central Italy. Unpubl. PhD thesis, University of Aberdeen.
Rahm, U. & Born, E. (1976). De l’alimentation du blaireau. Diana 93(11): 338-341.
Rasa, O. A. E. (1987). The dwarf mongoose : a study of behaviour and social structure in relation to the ecology in a small, social carnivore. Adv. Study Behav. 50: 225-249.
Roper, T. J. (1992). The structure and function of badger setts. J. Zool., Lond. 227: 691-694.
Roper, T. J. & Lüps, P. (1995). Diet of badgers (Meles meles) in central Switzerland : an analysis of stomach contents. Z. Säugetierk. 60(1): 9-19.
Roper, T. J., Shepherdson, D. J. & Davies, J. M. (1986). Scent marking with faeces and anal secretion in the European badger (Meles meles) : seasonal and spatial characteristics of latrine use in relation to territoriality. Behaviour 97: 94-117.
Sandell, M. (1989). The mating tactics and spacing patterns of solitary carni-vores. In Gittlemann, J. L. (ed.). Carnivore behaviour, ecology, and evolution. Chapman & Hall, London & Cornell University Press, New York., pp. 164-182.
von Schantz, T. (1984a). Carnivore social behaviour – does it need patches ? Nature 307: 389.
Sheperdson, D. J., Roper, T. J. & Lüps, P. (1990). Diet, food availability and foraging behaviour of badgers (Meles meles L.) in southern England. Z. Säugetierk. 55(2): 81-93.
da Silva, J., Woodroffe, R. B. & Macdonald, D. W. (1993). Habitat, food availability and group territoriality in the European badger, Meles meles. Oecologia 95: 558-564.
Skinner, C. A. & Skinner, P. J. (1988). Food of Badgers (Meles meles) in an arable area of Essex. J. Zool., Lond. 215: 360-362.
Skinner, C. A., Skinner, P. J. & Harris, S. (1991). An analysis of some of the factors affecting the current distribution of badger (Meles meles) setts in Essex. Mammal Rev. 21: 51-65.
Skoog, P. (1970). The food of the Swedish badger, Meles meles L. Viltrevy 7: 1-120.
Stocker, G. & Lüps, P. (1984). Qualitative und quantitative Angaben zur Nahrungswahl des Dachses Meles meles im schweizerischen Mittelland. Rev. Suisse Zool. 91: 1007-1015.
Stubbe, M. (1989). Dachs (Meles meles L.). In Stubbe, H. (Hrsgb.). Buch der Hege. Band 1 : Haarwild. Verlag Harri Deutsch, Thun und Frankfurt/Main, pp. 456-477.
Thornton, P. S. (1988) : Density and distribution of badgers in south-west England – a predictive model. Mammal Rev. 18(1): 11-23.
Touffet, J. (1982). Dictionnaire essentiel d’écologie. Ouest-France, Rennes.
Waser, P. M. (1981). Sociality or territorial defense ? The influence of resource renewal. Behav. Ecol. Sociobiol. 8: 231-237.
Wickler, W. (1967). Vergleichende Verhaltensforschung und Phylogenetik. In Heberer, G. (Hrsg.). Die Evolution der Organismen. 3. Aufl. Band I. Fischer, Stuttgart.
van Wijngaarden, A. & van de Peppel, J. (1964). The badger, Meles meles (L.), in the Netherlands. Lutra 6: 1-60.
Wilson, E. O. (1975). Sociobiology : The New Synthesis. Harvard University Press, Cambridge, MA.
Woodroffe, R. B. & Macdonald, D. W. (1992). Badger clans : demographic groups in an antisocial species. J. Zool., Lond. 227(4) : 696-698.
Woodroffe, R. B. & Macdonald, D. W. (1993). Badger sociality – models of spatial grouping. Symp. Zool. Soc. Lond. 65: 145-169.
Hypothèse du Seuil
Energétique Critique

© Georges Veya, 1996
Mise au point
Le développement de l’hypothèse abordée dans les pages suivantes faisant largement intervenir des notions ambiguës ou possédant plusieurs significations, il est nécessaire d’indiquer ici quel sens sera attribué aux différents termes utilisés :
Social : Une espèce est sociale « si la rencontre de plusieurs individus dans un espace restreint est un événement régulier et non fortuit » (Wickler 1967, cité dans Immelmann 1990), c’est-à-dire si elle vit durablement en couple, en famille ou en groupe et si le répertoire comportemental se compose en grande partie de conduites sociales.
Asocial / Solitaire : Une espèce asociale est composée d’individus ne formant ni couples ni groupes durables, mais vivants seuls la plupart du temps. Mâles et femelles occupent souvent des territoires séparés et ne se rencontrent qu’aux fins de l’accouplement (Immelmann 1990). Exemples : Paresseux, Orangs-outans, nombreux Félidés.
Non-coopératif : Qualifie un animal qui ne coopère jamais avec des individus conspécifiques, période de reproduction exceptée (Sandell 1989).
Corollaires :
Introduction
L’ordre des Carnivores présente une dualité intéressante quant à l’organisation sociale de ses membres. Alors que la plupart des espèces mènent une vie largement asociale (Lynx, Panthère,...; Sandell 1989), une minorité d’entre elles vit en groupes territoriaux de plus de deux adultes (voir Macdonald 1983, Gittleman 1989). Ceci à pousser les biologistes à se pencher sur les causes évolutives d’un tel comportement.
Plus particulièrement, lors des dix dernières années, le Blaireau européen (Meles meles) a fait l’objet de vives discussions ayant trait aux raisons de la socialité. Et pour cause. L’animal possède au sein de sa vaste aire de répartition une organisation sociale très variable, pouvant aussi bien mener une vie asociale que partager un terrier et un territoire avec d’autres congénères. Ceux-ci ne présentant pas de comportement de coopération évident, certains zoologistes ont essayé d’apporter une explication à l’évolution d’un tel phénomène (voir Fig. 1).
De manière générale, les hypothèses émises au sujet de la formation des "groupes spatiaux" (= non-coopératifs; Macdonald 1983) chez les Carnivores ont été concentrées sur la territorialité de groupe, celle-ci apparaissant pour des considérations d’ordre alimentaire (RDH, CTSH), génétique (TIH), ou défensive (AKH). Ces modèles – émis à l’origine pour d’autres espèces (RDH, CTSH : Renard; TIH : oiseaux et Renard; PRH : Mangouste à queue blanche) – ne s’appliquent malheureusement que de façon restreinte au cas du Blaireau européen. Par ailleurs, bien que ceux-ci traitent des circonstances favorables à la vie en groupe, ils ne livrent que peu voire pas d’explications sur la formation (ontogénie) ou sur les mécanismes de régulation de tels groupes.
Le présent chapitre a donc pour but de présenter une hypothèse, la HSEC (Hypothèse du Seuil Energétique Critique), qui pourrait expliquer la large gamme d’organisations spatiales et sociales observées chez cet animal, ainsi que les phénomènes de formation et de régulation des groupes. Mais avant de nous intéresser de plus près à cette nouvelle hypothèse, proposons-nous de faire un bilan des recherches effectuées à ce jour.
|
CARNIVORES |
|
||
|
|
|
|
|
|
|
|
|
|
|
La plupart vivent de façon solitaire (Sandell 1989) |
|
10-15 % vivent en groupes (Gittleman 1989) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Certains forment de véritables groupes sociaux et présentent un comportement coopératif très complexe :
|
|
D’autres ne présentent pas de bé-néfices évidents de la socialité. Macdonald (1983) a nommé de tels regroupements "groupes spatiaux", suggérant qu’ils se forment simplement parce que le mode de disponibilité alimentaire dans l’espace et dans le temps permet à plusieurs animaux d’oc-cuper la même région. *************************** Le Blaireau (Meles meles) est un exemple de tels animaux. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Aucune évidence d’un comporte-ment coopératif clair n’a été re-porté, bien que les blaireaux vi-vant en groupes puissent bénéfi-cier d’une probabilité croissante d’intercepter des intrus sur le territoire (Kruuk 1989) ou d’une possibilité de se réchauffer par temp froid en se serrant les uns contre les autres (Roper 1992). |
|
La plupart des explications sur l’existence des groupes spatiaux ont été concentrées sur la ter-ritorialité de groupe, posant la question pourquoi un animal pourrait défendre un territoire, probablement en réponse à la compétition, et permettre ensuite à d’autres animaux de s’établir en son sein. |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
Fig. 1 : Schéma montrant la position écologique particulière du Blaireau européen (Meles meles) au sein de l’ordre des Carnivores. [Etabli d’après des données de Woodroffe & Macdonald (1993).] |
|
Les zoologistes ont émis des hy-pothèses traitant des raisons de la territorialité et/ou des circonstan-ces favorables à la formation des groupes : RDH, CTSH, PRH, TIH, AKH (voir Fig. 2). |
|
Aperçu des connaissances actuelles
Organisation spatiale, territorialité et socialité
La grandeur du domaine vital d’un animal étant souvent difficile à estimer sans la technique de radiotélémétrie, ce n’est qu’à la fin des années 70 que furent livrées les premières données précises sur l’organisation spatiale des blaireaux. Celles-ci furent récoltées par le zoologiste hollandais Hans Kruuk (1978a), qui mena son étude dans la forêt de Wytham, en Angleterre. Sur un ensemble de douze animaux munis de colliers émetteurs et suivis régulièrement, la moyenne des domaines vitaux s’élevaient à 87 ha, avec des extrêmes allant de 21 à 107 ha. Mais les recherches s’étant multipliées dans plusieurs pays, nous savons aujourd’hui que la taille des domaines vitaux est très variable. Cheeseman et al. (1981) ont relevé une superficie minimale de 14 ha pour un groupe social de la région de Gloucestershire, en Angleterre. A l’opposé, une étude menée en Allemagne par Bock (1987) a montré qu’un animal utilisait un espace de 1’000 ha, soit une surface 70 fois supérieure à la première !
Parallèlement aux variations enregistrées dans la taille des domaines vitaux, les biologistes ont également constatées des différences au niveau de l’intensité avec laquelle les blaireaux défendaient ces espaces en tant que territoires. Kruuk (1978a) mentionne ainsi que les blaireaux de Wytham possèdent de véritables territoires, disposés autour d’un terrier principal, et délimités par un système de stations marquées de signaux olfactifs laissés par les animaux, les latrines. L’auteur a même observé plusieurs combats entre différents individus survenus à la frontière de leurs territoires. En revanche, une autre étude de Cresswell et Harris (1988) a livré des observations tout à fait divergentes. Les blaireaux de la région de Bristol, également en Angleterre, ne présente pas un comportement territorial aussi marqué, les latrines étant pour leur part située en majorité à moins de cinquante mètres des terriers.
Une dernière variation, et non des moindres, concerne l’organisation sociale de l’espèce. Le Blaireau échappe en effet à la classification ambivalente d’animal asocial ou social, celui-ci pouvant – suivant son aire de répartition et divers facteurs environnementaux – adopter l’un ou l’autre de ces modes de vie. Ainsi, dans plusieurs régions de Grande-Bretagne, les territoires sont partagés par des groupes stables comprenant jusqu’à 35 individus (Neal & Cheeseman 1996). Mais ailleurs, comme dans le Parc National de Doñana, en Espagne, les blaireaux vivent en couple (Martin-Franquelo & Delibes 1985). En Italie, dans le Parc Naturel de Maremma, Pigozzi (1987) note que les blaireaux vivent de façon asociale et que les territoires sont donc occupés et défendus aussi bien par des mâles que des femelles.
En faisant un bilan de ces différentes données, on pourrait croire que la taille du groupe est intimement liée à la grandeur du territoire. Mais il n’en est rien. Kruuk & Parish (1982) on montré qu’il n’existe aucun lien entre ces deux variables, et ceci, aussi bien à l’intérieur d’une population qu’entre plusieurs d’entre elles.
Un dernier mot encore relativement à la structure sexuelle des groupes. Ces derniers sont habituellement constitués d’animaux des deux sexes, bien qu’on ait aussi observé des groupes formés uniquement de mâles (Kruuk 1978a) ou exclusivement de femelles (da Silva 1989).
Discussions sur la vie de groupe
De manière générale, les zoologistes pensent que les bénéfices retirés par les membres d’un groupe résultent (i) d’une plus grande capacité à échapper aux prédateurs ou à s’en défendre, (ii) d’une plus grande facilité à acquérir de la nourriture, et/ou (iii) de contraintes environnementales ou sociales forçant les individus à s’unir (Caro 1994).
Le Blaireau européen n’ayant que très peu de prédateurs (Lynx, Loups, Ours et Rapaces s’attaquent éventuellement aux jeunes), l’hypothèse de défense contre des prédateurs (i) ne peut être retenue pour expliquer la formation des groupes. De fait, aucun comportement de vigilance organisée (certains individus gardant le territoire pendant que d’autres s’adonnent à des activités différentes : séances de toilettage, recherche de nourriture, apport de litière, excavation de nouvelles galeries) n’a été reporté. Par ailleurs, chaque individu recherchant sa nourriture seul (Kruuk 1978a), l’hypothèse alimentaire (ii) est également à éliminer.
Il nous reste donc à considérer la troisième hypothèse (iii). Récemment, Roper (1992) a montré que les blaireaux dorment séparément durant l’été, mais se serrent les uns contre les autres lors des froides journées d’hiver. D’après lui, la possibilité de se réchauffer par temps froid pourrait fournir un bénéfice suffisamment grand aux individus pour les inciter à former un groupe lorsque le partage du domaine est peu coûteux. Le fait que les blaireaux soient moins sociaux dans les parties méridionales de leur aire de répartition (Italie, Espagne), où les bénéfices d’un tel comportement sont vraisemblablement plus faibles, semble soutenir cette théorie. Cependant, en Suède, où l’hibernation sociale pourrait être un avantage, les blaireaux mènent pour la plupart une vie de couple (Lindström, cité dans Woodroffe & Macdonald 1993). En conclusion, cette attitude des animaux en réponse au facteur climatique ne saurait expliquer à elle seule la formation de groupes chez cette espèce.
Hypothèses sur la formation des groupes
L’apparition de la socialité chez les blaireaux ne pouvant s’expliquer par ces trois avantages fonctionnels "courants", les zoologistes ont émis l’hypothèse que le comportement territorial était un passage obligé à la formation des groupes chez cette espèce. Ils ont dès lors concentré la plupart des discussions sur la territorialité de groupe, suggérant des circonstances sous lesquelles les détenteurs d’un territoire pouvaient retirer des bénéfices en permettant à d’autres animaux de partager leurs territoires (voir Fig. 2).
|
|
|
cOMPÉTITION INTRASPéCIFIQUE ® Kruuk 1989 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
DÉFENSE des ressources alimentaires ® RDH, CTSH |
|
|
|
DÉFENSE des femelles par les mâles ® AKH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
TERRITORIALITÉ |
|
|
|
|
|
|
|
|
|
Répartition et variations spatio-temporelles des parcelles alimentaires ® RDH |
|
|
|
Le partage du territoire permet d’accroître le fitness des propriétaires ® TIH |
|
|
|
|
|
|
|
Fluctuations inter-annuelles de la nourriture ® CTSH |
|
|
|
Vitesse de renou- vellement des proies ® PRH |
|
|
|
|
|
|
|
Régulation ® TIH |
|
FORMATION DE GROUPES SPATIAUX |
|
|
Fig. 2 :
Plusieurs hypothèses ont été formulées pour expliquer la formation de groupes spatiaux (= non-coopératifs) chez le Blaireau européen (Meles meles). Certains modèles stipulent que le comportement territorial est une condition prérequise à leur formation (RDH, CTSH, TIH), alors que celui-ci ne semble pas être un passage obligé pour la PRH. L’AKH, tout comme la RDH et la CTSH d’ailleurs, abordent les raisons de la territorialité. Finalement, la TIH semble apporter des explications au phénomène de la régulation des groupes.RDH : Resource Dispersion Hypothesis Macdonald (1981, 1983)
CTSH : Constant Territory Size Hypothesis Lindström (1980a), von Schantz (1984a)
AKH : Anti-Kleptogamy Hypothesis Roper et al. (1986)
TIH : Territory Inheritance Hypothesis Lindström (1986)
PRH : Prey Renewal Hypothesis Waser (1981)
Trois modèles considèrent que le mode de disponibilité alimentaire dans l’espace et dans le temps permet à plusieurs animaux d’occuper la même région. Alors que la RDH (Resource Dispersion Hypothesis) se concentre sur la distribution spatio-temporelle de la nourriture au long d’une année, la CTSH (Constant Territory Size Hypothesis) attache une plus grande importance aux fluctuations inter-annuelles des ressources alimentaires. La PRH (Prey Renewal Hypothesis) souligne quant à elle le rôle prépondérant joué par la vitesse de renouvellement des proies dans la formation des groupes.
Un autre modèle, la TIH (Territory Inheritance Hypothesis), axe son argumentation sur l’augmentation du "fitness" des propriétaires initiaux d’un territoire en s’assurant que celui-ci soit hérité par leurs descendants, c’est-à-dire des porteurs de leurs propres gènes.
Une fois analysés les facteurs pouvant inciter les propriétaires initiaux d’un territoire à partager celui-ci avec des congénères, il s’agissait encore de fournir des explications au phénomène de la territorialité. A défaut d’une défense contre les prédateurs ou interspécifique, Kruuk (1989) pense que les territoires sont établis en réponse à la compétition intraspécifique, les blaireaux vivant en groupes pouvant même bénéficier d’une probabilité croissante d’intercepter des intrus sur le territoire. Continuant plus loin dans cette voie, certains scientifiques basent leurs modèles sur la défense des ressources alimentaires (RDH, CTSH). Toujours dans la même optique, mais dans un autre registre, Roper et al. (1986) pensent que les territoires sont tenus par les mâles pour défendre les femelles (AKH : Anti-Kleptogamy Hypothesis).
Nous allons maintenant passer en revue ces différents modèles et analyser leur prédictions (voir aussi Tab. 1). La plupart d’entre eux sont envisagés par rapport à une stratégie "contractionniste" (Kruuk & Macdonald 1985), l’animal cherchant à défendre, pour des raisons d’économie de moyens, le plus petit territoire possible.
Resource Dispersion Hypothesis (RDH)
Cette hypothèse proposée par Macdonald (1981, 1983) met l’accent sur le fait que la vie en groupe est facilitée par un environnement dans lequel les ressources alimentaires sont réparties en parcelles ("patches") et varient dans le temps et/ou l’espace. Il est ainsi possible de distinguer un aspect temporel (1) et un aspect spatial (2) (Woodroffe & MacDonald 1993).
(1) Carr & Macdonald (1986) on établi un modèle basé sur l’aspect temporel en partant du principe que les parcelles alimentaires sont fixes, mais que les ressources qu’elles renferment fluctuent temporellement. Dans leur scénario, les individus alpha (couple reproducteur) choisissent un territoire en fonction de leur "sécurité alimentaire critique", c’est à dire que celui-ci contiendra le minimum de parcelles de nourriture leur permettant de vivre, malgré un nombre critique de mauvaises nuits de chasse. A l’inverse, les ressources variant dans le temps, il y a un certain nombre de nuits où la nourriture est en surplus. Le territoire peut donc accueillir des individus beta, dont le nombre dépendra de leurs besoins et de la fréquence à laquelle le territoire fournira suffisamment de ressources en surplus. Comme l’avaient déjà proposé Kruuk & Parish (1982), la dimension du territoire serait dans ce cas fixée par la répartition des parcelles et l’effectif du groupe par la richesse de celles-ci. Les travaux de Bacon et al. (1991a, 1991b, cités dans Meia 1994) ont cependant montré que ces relations se vérifiaient surtout lorsque les parcelles sont très riches et contiennent assez de nourriture pour plusieurs individus; lorsque la richesse des parcelles est moins grande, il devient important que deux parcelles soient disponibles au même moment; l’effectif du groupe et la dimension du territoire peuvent alors être corrélés.
Le scénario des "parcelles très riches" s’applique bien à la situation observée dans de nombreux sites en Angleterre (Wytham, Gloucestershire), où les blaireaux se nourrissent presque exlusivement de vers de terre. Les parcelles contenant des vers y ont en effet une faible probabilité d’être disponibles simultanément (dépendant largement des conditions microclimatiques), mais vu la forte probabilité que l’une d’entre elles soit accessible chaque nuit, la formation de groupes n’est pas entravée. Le modèle prédit également que la formation des groupes est moins probable dans des environnements moins variables, puisque les animaux n’y ont pas besoin de choisir une grande "assurance alimentaire". Nous verrons cependant que la HSEC arrive à des conclusions tout à fait divergentes.
(2) L’aspect spatial de la RDH considère la répartition spatiale de parcelles alimentaires qui varient temporellement (en fonction de la saison ou des conditions climatiques). Il se base sur le fait que lorsque les parcelles sont rapprochées, leur dispersion est très irrégulière (Kruuk 1978b, 1989; Doncaster & Macdonald 1992). Dans une telle situation, le tracé ajusté aux parcelles nécessaires pour nourrir le couple alpha est très sinueux. Un territoire légèrement plus grand avec un individu supplémentaire apporte une sécurité alimentaire plus grande et un coût de défense per capita plus faible. En revanche, lorsque les parcelles sont très espacées, leur dispersion est plus régulière. Une augmentation de la dimension du territoire mènerait alors à défendre un plus grand périmètre sans augmentation de la sécurité alimentaire.
Pour la version spatiale de la RDH, la formation de groupes est limitée aux zones à parcelles rapprochées, réparties de manière hétérogène. La HSEC prédit en revanche que des groupes peuvent se former également dans des régions où les ressources sont distribuées homogènement (voir von Schantz 1984a).
Constant Territory Size Hypothesis (CTSH)
Cette hypothèse formulée tout d’abord par Lindström (1980a) a été développée par von Schantz (1984b). Elle repose sur le principe que, dans un environnement où les ressources présentent de fortes fluctuations inter-annuelles, un animal aurait avantage à maintenir un territoire constant et suffisamment grand pour qu’il puisse survivre lors des années néfastes (stratégie obstinée). Un tel territoire devrait permettre à d’autres animaux, généralement des descendants, de rester à l’intérieur du territoire pendant les années d’abondance, ceux-ci étant évincés lorsque la disponibilité alimentaire baisse. Une stratégie plus flexible, c’est-à-dire modifier la dimension du territoire en fonction de la quantité de nourriture à disposition, engendrerait des coûts considérables pour agrandir le territoire lorsque les ressources diminuent, puisque l’animal devrait se battre avec ses voisins. La stratégie obstinée serait adoptée dans les cas où la durée de vie de l’animal est plus longue que la période de fluctuation des ressources (par ex. Blaireau). Le principal problème posé par ce modèle est qu’il n’explique pourquoi les blaireaux peuvent aggrandir leur territoire lorsque les conditions sont particulièrement critiques, alors qu’ils devraient plutôt évincer un ou plusieurs individu(s), de façon à maintenir la taille du territoire constante (voir Kruuk & Parish 1987).
Territory Inheritance Hypothesis (TIH)
Selon Lindström (1986), les groupes apparaissent lorsque l’environnement est saturé et, par conséquent, le succès de la dispersion faible. Les territoires environnants étant tous occupés, les subadultes demeurent dans le territoire parental en tant qu’individus non-reproducteurs. A la mort de l’un des reproducteurs, un descendant hérite de son statut et du territoire. Les propriétaires initiaux du territoire (parents), tout comme les individus béta (subadultes), trouvent un avantage dans une telle situation, puisque la chance de voir leurs gènes se transmettre aux générations futures ("fitness") augmente. Cependant, ce modèle n’explique pas véritablement les raisons qui amènent à la formation d’un groupe spatial, mais plutôt pourquoi un tel groupe se maintient (voir Artois 1989, Woodroffe & Macdonald 1993).
Anti-Kleptogamy Hypothesis (AKH)
Cette hypothèse a été énoncée par Roper et al. (1986). Ceux-ci soutiennent que les territoires ne sont pas tenus en défense d’une source de nourriture ou pour des raisons génétiques, mais sont maintenus par un ou plusieurs mâles pour défendre les femelles. Que ceci soit le véritable motif de la territorialité ou non n’explique cependant pas pourquoi les femelles en arrivent à former des groupes.
Prey Renewal Hypothesis (PRH)
L’hypothèse formulée par Waser (1981) suggère que la territorialité apparaît lorsque le renouvellement des proies est lent, situation où l’impact compétitif des conspécifiques est probablement plus grand. En revanche, si les proies se renouvellent rapidement, il n’y a pas nécessité pour l’animal d’être territorial, d’autres individus pouvant être tolérés dans le domaine vital. Ce modèle correspond assez bien au cas du Blaireau : lorsqu’il se nourrit principalement de lapins (Oryctolagus cuniculus) (Espagne), on observe un système territorial de couple; lorsque celui-ci se nourrit de proies à renouvellement très rapide, comme les vers de terre (Grande-Bretagne), on observe une vie en groupe. Malheureusement, ce modèle ne fournit aucune explication à la territorialité de groupe (Kruuk 1978a), ni n’explique comment la dimension du domaine vital (resp. territoire) est choisie par les animaux.
La critique la plus importante que l’on puisse adresser aux quatre premières hypothèses concerne le fait qu’elles n’expliquent pas la présence de groupes spatiaux non territoriaux, comme observés par Cresswell & Harris (1988). Par ailleurs, elles ne s’appliquent malheureusement que de façon restreinte (géographiquement ou temporellement) au cas du Blaireau européen. En conclusion, aucune d’elles n’apportent d’explication complète sur les différents types d’organisations spatiales et sociales présents chez cette espèce, justifiant ainsi l’élaboration d’un nouveau modèle plus adéquat.
Tab. 1 :
Résumé des caractéristiques des différentes modèles élaborés sur la formation des groupes spatiaux chez les Carnivores, et en particulier chez le Blaireau européen.|
Kruuk |
Défense du territoire moins coûteuse |
Compétition intraspécifique |
Répartition des parcelles alimentaires |
Richesse des parcelles alimentaires |
Mortalité et émigration jouent un rôle important |
|
AKH |
¾ |
Défense des femelles par les mâles |
¾ |
¾ |
¾ |
|
PRH |
Vitesse de renouvellement des proies |
La formation d’un territoire n’est pas requise |
? (Les animaux possèdent un domaine vital) |
Quantité de nourriture contenu dans le domaine vital |
? |
|
TIH |
Augmentation de l’efficience darwinienne (fitness) des propriétaires |
? |
? |
Théorie : 4-5 adultes au maximum |
Théorie (voir Lindström 1986 ) |
|
CTSH |
Fluctuations inter-annuelles des ressources alimentaires |
Défense de la nourriture |
En fonction des périodes de "bottleneck" |
Quantité de nourriture contenu dans le territoire |
Démographi-quement en fonction de la quantité de nourriture |
|
RDH |
Variations spatio-temporelles des ressources alimentaires |
Défense de la nourriture |
Répartition des parcelles alimentaires et distance entre celles-ci |
Richesse des parcelles alimentaires |
Démographi-quement en fonction de la quantité de nourriture |
|
PARAMETRES |
Facteur favorisant la vie en groupe |
Raisons de la territorialité |
Facteur(s) déterminant la taille et l’allure du territoire ou du domaine vital |
Facteur déterminant la taille du groupe |
Comment le groupe est-il régulé ? |
Construction de la HSEC
Quelles explications la HSEC veut-elle apporter ?
La grande variabilité dans l’organisation spatiale et sociale du Blaireau européen en liaison avec la grande flexibilité dans le choix de son habitat et de son alimentation soulève trois grandes questions : Sous quelles conditions les groupes apparaissent-ils ? Pourquoi, quand et comment se forment-ils ? Et finalement, comment sont-ils régulés ? Par ailleurs, deux autres questions découlent de l’existence de la territorialité de groupe : Qu’est-ce qui détermine la taille du territoire, et qu’est-ce qui défini la taille du groupe ? C’est à toutes ces interrogations que la HSEC aimerait fournir des réponses.
Hypothèse de départ
« Le comportement territorial ne semble pas être une condition prérequise pour la formation des groupes chez les blaireaux, bien que cela soit une caractéristique de leur maintien dans plusieurs régions » (Woodroffe & Macdonald 1993).
Les études menées dans les années 80 sur le Blaireau ayant apporté de nouvelles données sur l’organisation spatiale de l’espèce dans différentes régions ainsi que sur le processus de la formation des groupes, Woodroffe et Macdonald (1993) ont récemment effectué une revue des différentes hypothèses en tenant compte de ces derniers résultats. Ils suggèrent que, « chez les blaireaux, la territorialité est un puissant facteur contribuant à la maintenance des groupes sociaux, mais qui joue un moindre rôle dans leur formation (ontogénie) ». En accord avec les deux auteurs, j’embrasserai cette hypothèse de départ.
Les deux auteurs formulent même le développement suivant : « Les groupes s’établissent vraisemblablement car le renouvellement rapide des proies signifie que les coûts engendrés par le partage du domaine sont faibles par rapport aux coûts de la dispersion dans les premières étapes de colonisation. Lorsque la densité de population augmente, la compétition pour la nourriture croit et les domaines vitaux sont défendus en tant que territoires, de sorte que la dispersion devient même plus coûteuse. A ce stade, la taille du territoire est apparemment définie par la distribution spatiale de ressources-clés, telles que les parcelles de nourriture ou les sites des terriers. La taille du groupe se limite ensuite aux nombre d’animaux qui peuvent être "supportés" par ce territoire minimum, bien que le mécanisme de la régulation des groupes ne soit pas encore clair actuellement ».
Ce raisonnement, nous le verrons, s’inscrit bien dans ligne de pensée de la HSEC. Mais avant de nous pencher sur la HSEC à proprement parler, il me faut encore définir deux points très importants. Premièrement, quels types de facteurs alimentaires sont susceptibles d’influencer la formation des groupes, et deuxièmement, comment la taille du domaine vital ou du territoire est choisie.
Facteurs alimentaires influençant la formation des groupes
De nombreuses études sur les Oiseaux (Crook 1964), les Primates (Crook & Gartlan 1966, Clutton-Brock & Harvey 1977), les grands Carnivores (Kruuk 1972, 1975) et plusieurs autres groupes d’animaux (revue dans Wilson 1975) ont montré qu’il existait un lien étroit entre l’organisation sociale d’une espèce et la façon dont elle exploite ses vivres.
Il n’est donc pas étonnant que trois des modèles élaborés jusqu’ici sur la socialité chez les blaireaux se basent eux aussi sur des considérations d’ordre alimentaire, le mode de disponibilité alimentaire dans l’espace et dans le temps permettant à plusieurs animaux d’occuper la même région. Le mérite de ces différentes théories réside dans le fait qu’elles ont montré que certains facteurs (ou circonstances) pouvaient inciter les propriétaires initiaux d’un territoire au regroupement avec des congénères. Une telle situation leur fournissant des bénéfices non négligeables, contrebalançant ainsi d’autres coûts substantiels à endurer, tels que le partage de la nourriture ou des partenaires sexuels.
Le principal reproche qu l’on puisse faire à ces modèles concerne le fait qu’ils ne s’appliquent qu’à un habitat type : celui du terrain d’étude des auteurs. Il est ainsi un peu présomptueux de croire qu’un facteur alimentaire – quel qu’il soit – puisse déterminer à lui seul la formation des groupes, et par conséquent l’organisation sociale des blaireaux dans l’ensemble de leur aire de répartition. Il me paraît plus judicieux d’émettre l’hypothèse que de nombreux facteurs interviennent dans cette problématique, certains pouvant – localement ou périodiquement – avoir un impact plus grand que les autres. Je retiendrai donc les facteurs suivants pour l’élaboration de mon hypothèse :
Facteurs alimentaires (plus ou moins interdépendants) influençant la formation des groupes :
Comment la dimension et l’allure du domaine vital ou du territoire sont-elles choisies ?
La plupart des explications apportées jusqu’ici sur le choix du domaine vital chez les blaireaux se basent avant tout sur des considérations d’ordre alimentaire. Kruuk et Parish (1982) suggèrent ainsi que la répartition spatio-temporelle et la richesse des parcelles alimentaires jouent un rôle prépondérant dans la taille du territoire. Doncaster et Woodroffe (1993) ont montré par la suite que la taille du territoire pouvait dépendre de la répartition des terriers ou des sites favorables à leur construction.
Ces deux éléments influencent sans aucun doute l’animal lorsqu’il choisit la taille et l’allure de son domaine vital, mais il s’agirait de ne pas sous-estimer le rôle que peuvent jouer d’autres facteurs, que je passe en vue ci-dessous :
Facteurs déterminant la dimension et l’allure du domaine vital :
Ainsi, contrairement à différents modèles émis jusqu’ici, l’animal choisit un domaine vital minimum non pas seulement en regard de la quantité de nourriture assurant sa survie, mais en fonction d’un compromis basé sur les différents paramètres énoncés ci-dessus lui permettant de dépenser une énergie minimale.
Les deux phases explicatives de la HSEC : habitat optimal et habitat suboptimal
Les facteurs alimentaires évoqués auparavant étant très variables aussi bien géographiquement que temporellement, et ceux-ci contribuant largement à la qualité de l’habitat, on peut s’attendre à ce que celui-ci soit dans certaines situations très favorable à l’établissement d’un animal en son sein, et dans d’autres, plutôt défavorable.
Partant de ce principe de base très simple, la HSEC se propose de considérer le cas d’un blaireau – parti du domaine natal, par exemple – désirant coloniser un nouveau milieu. Celui-ci peut alors être confronté à deux cas de figure très différents. La première situation correspond à un habitat optimal pour l’animal, la seconde à un habitat suboptimal. Il convient ici de définir ce que j’entends par optimal et suboptimal. Comme le montre la Fig. 3, un habitat est optimal lorsque le domaine vital défini par le blaireau contient suffisamment de nourriture pour plus d’un individu, et ceci tout au long de l’année. Un habitat est par conséquent suboptimal, lorsque ces conditions ne sont pas requises. Dans cette optique, nous pouvons répartir chacun des 4 facteurs alimentaires considérés auparavant en deux catégories opposées, relativement à l’influence, favorable ou néfaste, qu’ils exercent sur la qualité de l’habitat (voir Tab. 2).
(1) Un premier type d’habitat optimal trivial est constitué par un environnement où la nourriture est distribuée de façon continue – et par conséquent homogènement – et la densité et/ou qualité de ces ressources est haute. Inversément, si la densité (et/ou qualité) de nourriture est faible, l’habitat est suboptimal.
(2) Un environnement constitué de nombreuses parcelles alimentaires très riches, distribuées homogènement ou hétérogènement, et proches les unes des autres peut aussi constituer un habitat optimal pour l’animal, car celui-ci devra dépenser peu d’énergie pour atteindre la nourriture. En revanche, lorsque les parcelles très riches sont peu nombreuses et distantes, la qualité des parcelles est largement eclipsée par l’importante dépense énergétique à fournir lors des déplacements.
(3) L’habitat peut également être favorable lorsque les parcelles sont moins riches, à condition qu’elles soient très rapprochées et que plusieurs d’entre elles soient accessibles au même moment. Si tel n’est pas le cas, l’habitat considéré est plutôt suboptimal.
Tab. 2 :
Paramètres alimentaires déterminant la qualité de l’habitat.|
Paramètres alimentaires |
Habitat optimal |
Habitat suboptimal |
(1) Distribution spatiale de la nourriture |
Homogène continue |
Homogène continue |
Densité et/ou qualité des ressources alimentaires |
Haute |
Faible |
(2) Distribution spatiale de la nourriture |
Homogène discontinue, ou hétérogène |
Homogène discontinue, ou hétérogène |
Nombre de parcelles très riches Distance entre les parcelles |
Plusieurs Relativement courte |
Peu Longue |
(3) Distribution spatiale de la nourriture |
Homogène discontinue, ou hétérogène |
Homogène discontinue, ou hétérogène |
Variation spatio-temporelle des ressources alimentaires Distance entre les parcelles |
Plusieurs parcelles contiennent suffisam-ment de nourriture au même moment Courte |
La nourriture des parcelles est accessible à des moments différents Longue |
(4) Distribution spatiale de la nourriture |
Hétérogène |
Hétérogène |
Renouvellement des proies |
Rapide |
Lent |
(1) optimal (1) suboptimal
(2) optimal (2) suboptimal
(3/4) optimal (3/4) suboptimal
Fig. 3 :
Différents types d’habitats optimaux et suboptimaux. L’habitat des blaireaux est représenté par un carré contenant des ressources alimentaires distribuées homogènement (petits points noirs) ou en parcelles (gros points noirs) plus ou moins riches. Le domaine vital choisi par l’animal colonisateur est représenté sous la forme d’un polygone. Dans un habitat optimal (rangée gauche), ce domaine vital, défini selon divers critères, contiendra assez de nourriture pour plusieurs individus durant toute l’année. En revanche, dans un habitat suboptimal (rangée droite), celui-ci lui procurera juste de quoi vivre; de la nourriture en surplus peut éventuellement être présente à différentes périodes de l’année. En comparaison, la taille du domaine vital (habitat suboptimal) qui contiendrait autant de nourriture que dans l’habitat optimal est figurée par un polygone à ligne discontinue. Les chiffres donnés entre parenthèses correspondent aux quatre types d’habitats décrits dans le texte et le Tab. 2.(4) Finalement, comme l’a suggéré Waser (1981), un environnement dans lequel les proies (ou autres types de nourriture), disposées hétérogènement, se renouvellent rapidement, peut aussi constituer un habitat favorable. Au contraire, plus la régénération des ressources alimentaires est lente, plus la qualité de l’habitat ira "descrescendo".
Ayant défini précisément les deux catégories d’habitats pouvant se présenter à un animal colonisant un nouveau milieu, nous pouvons maintenant nous concentrer sur les prévisions de la HSEC pour chacun de ces cas de figure. Ceux-ci, nous allons le voir, mènent à des prédictions divergentes quant à l’organisation spatiale et sociale des blaireaux.
6. Formulation de la HSEC dans un habitat optimal
Colonisation d’un espace vacant et passage d’un système non territorial à un système territorial
Une fois trouvé un habitat à sa convenance, l’animal va se doter d’un domaine vital, choisissant – comme nous l’avons vu – la grandeur et l’allure de celui-ci en fonction de différents facteurs, telle que la structure de l’habitat, la présence de compétiteurs ou d’éléments déstabilisants, mais surtout en fonction de ses besoins vitaux. Comme ce domaine vital n’est pas défendu en tant que territoire, l’animal adopte un système non territorial individuel : l’énergie qu’il dépense se limite à la recherche de nourriture. Je la désignerai par le terme d’énergie de déplacement.
La situation va cependant évoluer avec la venue d’autres colonisateurs (voir Fig. 6). Dans un premier temps, ceux-ci peuvent, si des terriers vacants ou des sites propices à leur construction sont présents, s’installer dans le voisinage, en vivant également de façon asociale. Cette situation peut durer jusqu’à ce que les colonisateurs successifs ne trouvent plus de terriers où s’installer. Ceux-ci devront alors se joindre à un animal possédant un terrier. L’habitat étant optimal, cette situation n’augmente pas significativement l’énergie dépensée par le propriétaire initial. La densité dans la région pourra ainsi croître suite à l’augmentation du nombre de blaireaux dans chaque terrier par le phénomène de colonisation. On assiste alors à la formation de groupes non territoriaux. Si les terriers libres sont rares dans les environs ou que les conditions nécessaires à leur excavation ne sont pas réunies (propriétés du sol, présence de forêts,...), il n’est pas exclu que quelques individus colonisateurs (peut-être issus d’un même clan) forment directement un groupe non territorial. Une étude de Cheeseman et al. (1993) a montré que des groupes peuvent se former avant même que les limites du territoire soient définies, suggérant effectivement que le partage d’un territoire est relativement peu coûteux pour les blaireaux vivant dans un habitat optimal.
Dans une étape ultérieure, l’augmentation démographique s’opèrera également par la naissance de jeunes, soit suite à l’accouplement des membres d’un même terrier (ou clan), où successivement à l’union d’individus de terriers (ou clans) avoisinants. En effet, les systèmes adoptés étant non territoriaux, il est fort probable que les domaines vitaux des différents groupes se superposent en partie. Les futurs subadultes auront la possibilité de rester dans leur petit groupe d’origine, ou alors de rejoindre un groupe voisin.
Quoi qu’il en soit, avec l’augmentation significative de la densité de population dans la région, l’énergie dépensée va croître, car les individus devront parcourir de plus longues distances, éviter les concurrents ou s’investir éventuellement dans des affrontements. A une énergie de déplacement plus grande s’ajoute encore une énergie de compétition. Lorsque la densité atteint une valeur critique ("premier seuil énergétique critique", par exemple 7 individus pour le cas de la Fig. 5), il devient plus judicieux d’adopter un système territorial de couple. En effet, à ce stade, l’énergie globale à fournir par un individu dans un territoire (énergie de déplacement plus énergie de défense individuelles) est plus faible que celle dépensée dans le système non territorial (énergie de déplacement plus énergie de compétition individuelles). Il y a certes équivalence entre l’énergie de compétition et l’énergie de défense dans chacun des systèmes, mais en revanche l’énergie de déplacement sera plus faible dans le système territorial, la nourriture nécessaire étant à nouveau "confinée" dans un espace plus restreint.
Le Graphique 1 montre que si le système social ne bascule pas immédiatement, l’énergie per capita dépensée peut hypothétiquement croître jusqu’à ce qu’elle dépasse la valeur de l’énergie que fournirait un animal en formant un système territorial individuel. Le changement de système s’opèrerait donc plus tard. Ce scénario paraît cependant moins probable, vu les énormes sacrifices énergétiques à concéder par les individus jusqu’à l’atteinte du "deuxième seuil critique". Un autre scénario imaginable consisterait en la formation directe, une fois le premier seuil critique atteint, d’un système territorial de groupe, vu que l’énergie dépensée per capita y est encore plus faible que dans le système de couple. Celui-ci pourrait par exemple se former lorsque les individus partageant un terrier sont parents. Quoi qu’il en soit, lorsque la densité atteinte dans l’espace colonisé est trop grande, un groupe territorial individuel, de deux, trois ou plusieurs individus se formera, conformément à la baisse d’énergie globale à fournir.
En revanche, en reprenant l’exemple du Graphique 1, je n’envisage pas la possibilité d’un passage direct (énergétiquement réalisable) d’un groupe non territorial de 5 individus à un groupe territorial (de 5 individus). L’atteinte du premier seuil énergétique critique représente sans doute un stimulus nécessaire pour déclencher la transition entre les différents systèmes sociaux.
Formation de groupes territoriaux (spatiaux) stables
Lorsque la nourriture présente sur le territoire est suffisante, le couple ou les membres du groupe territorial nouvellement formés peuvent admettre d’autres individus dans leur domaine vital (voir Fig. 5 et Graphique 2). Celui-ci n’étant pas seulement choisi en fonction de la nourriture, il est fort probable qu’il croisse légèrement au fur et à mesure que le nombre d’individus admis augmente (besoin d’espace physique !), mais en contre partie, l’énergie de défense à fournir par chaque individu diminue. Cette baisse d’énergie étant plus grande en valeur absolue que celle fournie suite à l’augmentation de la distance de déplacement, la dépense énergétique totale de chaque individu diminue significativement. Le groupe atteint un effectif d’équilibre (6 individus dans l’exemple décrit) lorsque la surface alimentaire minimale pour nourrir le groupe coïncide avec le domaine vital de celui-ci. Il s’agit d’un point d’équilibre, car bien que l’acceptation de membres supplémentaires n’exigerait pas d’augmentation de l’énergie de défense individuelle, celle-ci entraînerait une énergie de déplacement légérement plus grande par individu.
Comme le confirment les observations de Cheeseman et al. (1987) en Angleterre, de tels groupes territoriaux peuvent être très stables, possédant des limites territoriales fixes durant de longues périodes – pouvant atteindre la décennie –, en dépit des fluctuations de la taille du groupe. De plus, lorsque plusieurs groupes sociaux furent retirés d’une région située à l’intérieur du site d’étude de Gloucestershire, très peu d’individus quittèrent leurs groupes d’origines pour recoloniser l’espace nouvellement créé. Il fallut d’ailleurs près de dix ans pour que les nouveaux groupes établissent leurs territoires (Cheeseman et al. 1993). On imagine en effet qu’un territoire plus grand, facile à s’approprier, demanderait par la suite une plus grande énergie de défense par individu, pour le même effectif.
seuil énergétique critique
Energie de déplacement
Energie de compétition
Energie de défense
équilibre
1 2 3 4 5 6 7 2 3 4 5 6 7 8
Nombre d’individus
Fig. 5 :
Evolution de l’énergie globale dépensée par un blaireau lors de la colonisation successive d’un espace vacant par plusieurs individus. On remarque qu’a partir d’une certaine densité critique (ici 7 individus; seuil énergétique critique), l’organisation sociale change. On passe d’un système non-territorial de groupe à un système territorial de couple. Pour la suite des explications, se réferer à la légende du Graphique 2.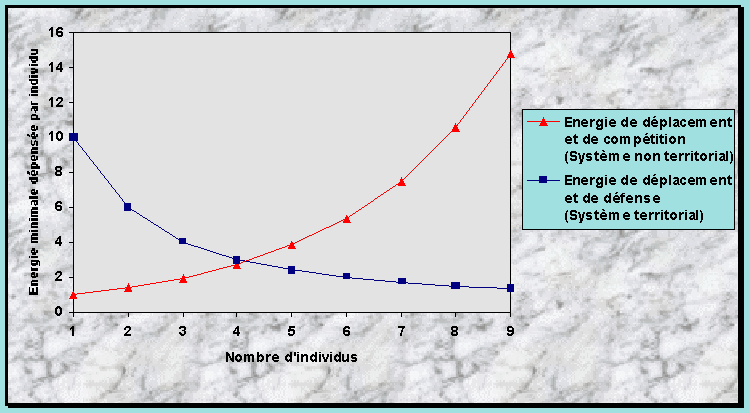
Graphique 1 :
Energie requise par un blaireau pour vivre dans son environnement. Lors de la colonisation d’un espace vacant, l’animal adopte un système non territorial : l’énergie qu’il dépense se limite à la recherche de nourriture (énergie de déplacement). Suite à l’augmentation de la densité par l’arrivée d’autres colonisateurs, l’énergie dépensée croit (ici exponentiellement), car l’individu doit parcourir de plus longues distances, éviter les concurrents ou s’investir dans d’éventuels affrontements (énergie de déplacement et de compétition). Il devient à ce moment là plus judicieux d’adopter par exemple un système territorial de couple, car l’énergie totale (énergie de déplacement et de défense) à dépenser par individu y est plus faible. Les flèches noires indiquent l’évolution du système social adopté par les blaireaux en fonction de l’augmentation de densité de population. Les deux cercles de droite (entourant les triangles rouges) désignent les premier et deuxième "seuils énergétiques critiques". Suite des explications dans la légende du Graphique 2.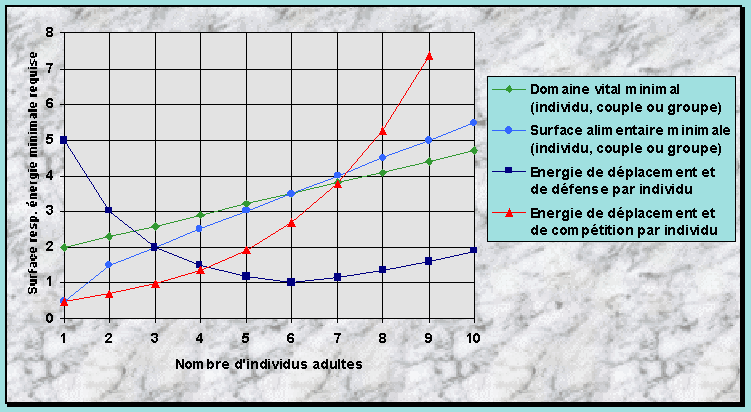
Graphique 2 :
Formation de groupes territoriaux (spatiaux) stables. Lorsque la quantité nourriture présente dans le territoire est suffisante, le couple peut accepter d’autres individus dans son domaine vital. Celui-ci croit légèrement au fur et à mesure que le nombre d’individus admis augmente, d’où une augmentation de l’énergie de déplacement, mais en contre partie, l’énergie de défense à fournir par chaque individu diminue. Le groupe atteint un effectif stable (équilibre, ici 6 individus) lorsque la surface alimentaire minimale pour nourrir le groupe coïncide avec le domaine vital de celui-ci.|
|
|
COLONISATION |
|
1) Dépense énergétique faible |
|
|
|
|
|
|
|
Nourriture abondante et/ou de haute qualité, répartie homogènement ® HSEC |
|
|
|
Plusieurs parcelles sont accessibles simultanément (distribution hétérogène) ® RDH |
|
La densité augmente démographiquement |
|
|
|
2) La dépense énergétique augmente |
|
Présence de plusieurs parcelles riches, rappro-chées, réparties homo- ou hétérogènement ® RDH |
|
|
|
Renouvellement rapide des proies (distribution hétérogène) ® PRH |
|
|
|
|
|
|
|
|
|
FORMATION DE GROUPES SPATIAUX NON TERRITORIAUX |
|
3) Dépense énergétique plus grande, mais supportable |
|
|
|
|
|
|
|
La densité augmente démographiquement |
|
|
|
4) La compétition intra-spécifique croit rapidement |
|
|
|
|
|
|
|
|
|
COMPÉtition intraspÉcifique ® Kruuk 1989 |
|
|
|
|
|
BILAN ENERGÉTIQUE DÉFAVORABLE ® HSEC |
|
5) La dépense énergétique est maximale (seuil critique) |
|
|
|
|
|
|
|
Défense des ressources alimentaires ® RDH, CTSH |
|
|
|
Défense des femelles par les mâles ® AKH |
|
|
|
|
|
|
|
Régulation ® HSEC |
|
TERRITORIALITÉ ® 1 individu ® de couple ® de groupe |
|
6) Dépense énergétique dé-croissante jusqu’à l’atteinte d’un point d’équilibre stable |
Fig. 6 :
Résumé de l’évolution de l’organisation sociale des blaireaux en fonction de l’augmentation de la densité de population dans un habitat optimal.Pourquoi l’effectif des groupes territoriaux peut-il varier de 2 à 35 individus ?
La HSEC, nous l’avons vu, permet d’expliquer la présence de différents systèmes sociaux chez les blaireaux vivant dans un habitat optimal et semble fournir une bonne explication au sujet de la formation des groupes territoriaux. Une question qui reste encore en suspens concerne la grande variation observée dans le nombre d’animaux qui constituent les groupes spatiaux. En fait, la réponse est directement liée à la qualité de l’habitat, comme l’avaient déjà signalé d’autres modèles. Un habitat peut certes être propice à la formation de groupes (territoriaux ou non), mais ceci ne veut pas dire pour autant qu’il contient suffisamment de nourriture permettant la formation de groupes sociaux démesurément grand. Ceci requiert un habitat exceptionnel, tel que cela semble être le cas pour certaines régions d’Angleterre. Ainsi le type d’habitat et son degré de qualité définissent la "capacité" maximale d’animaux qu’il pourra supporter.
Comment les groupes sont-ils régulés démographiquement ?
La HSEC nous livre également quelques prédictions très intéressantes quant à la régulation des groupes territoriaux en fonction de la disponibilité alimentaire et quant à l’utilisation de l’espace en fonction de la variation des facteurs démographiques (natalité, mortalité, immigration, émigration). Voici les prédictions de la HSEC pour un groupe territorial au point d’équilibre dans les deux cas de figure suivants :
La première méthode de régulation est sans doute souvent appliquée dans les grands groupes territoriaux. En effet, pour un clan assez nombreux, l’augmentation de l’énergie de défense indivuelle n’est pas très significative suite à la « perte » d’un membre. Certes, l’individu chassé devra faire preuve d’une grande force pour survivre, mais de cette façon, il ne met pas le groupe en danger. De telles régulations de densité (entre autre une diminution de la taille du groupe) sur un territoire aux limites très stables ont été observées par Cheeseman et al. (1987). Un cas d’augmentation de la mortalité a été apporté par l’étude de Nolet & Killingley (1987) dans la région de Buckinghamshire, en Angleterre. Ces biologistes ont enrégistré une diminution de la taille d’un groupe suite à l’abandon des pâturages et des champs avoisinants en vue de la construction d’un immeuble. Les années suivantes, le nombre de jeunes par portée diminua jusqu’à atteindre zéro. La grandeur du territoire, elle, n’avait pas changé, vraisemblablement car la situation géographique ne permettait aucune expansion de celui-ci.
La seconde prédiction de la HSEC correspond tout à fait aux observations de Kruuk & Parish (1987) à Speyside en Ecosse. Ils ont remarqué que lorsque les conditions sont particulièrement critiques, les terres vacantes sont immédiatement incorporées en territoire. En revanche, lorsque le territoire est lui-même entouré par d’autres territoires, la prise de "terres" à un ou plusieurs groupe(s) voisin(s) exige une trop grande dépense d’énergie. Les blaireaux ne se privent cependant pas d’aller se nourrir sur le territoire des voisins. Kruuk & Parish ont enregistré une augmentation de la superposition des domaines vitaux de différents groupes de 9 % à 23 % sur une période 5 ans, durant laquelle la disponibilité alimentaire baissait. De même, Sheperdson et al. (1990) ont observé une augmentation de ces superpositions à la fin de l’été, lorsque l’offre alimentaire est faible.
La première prédiction correspond à la formulation de la HSEC sur la formation de groupes territoriaux stables. Si le domaine vital contient une parcelle alimentaire inutilisée, le groupe peut admettre un nouvel individu. Cheeseman et al. (1987) ont par exemple observé l’admission de nouveaux membres dans leur terrain d’étude lors de périodes fastes. L’autre "solution" consiste à "jouer" avec le facteur natalité.
De même, il est possible qu’une augmentation à long terme de la quantité de nourriture puisse entraîner une contraction de la taille du territoire. da Silva et al. (1993) ont démontré qu’une augmentation de la qualité de l’habitat dans une partie du site d’étude de Wytham (Angleterre) – suite à un changement dans la pratique agricole – coïncidaient avec la fission de plusieurs territoires dans la région concernée.
En résumé, les conditions suivantes sont requises pour la mise bas par les femelles, la survie des jeunes ou l’émigration d’un individu dans le territoire :
Les prévisions de la HSEC pour un habitat suboptimal
Le scénario concernant l’habitat suboptimal peut maintenant s’expliquer très brièvement. Le domaine vital (en principe plutôt grand) choisi par un animal colonisateur ne pouvant fournir de la nourriture que pour un individu au maximum durant toute l’année (voir aussi Fig. 3), la formation de groupes spatiaux est improbable. La région concernée est/sera donc occupée par des animaux adoptant un système non territorial individuel, l’énergie dépensée se limitant à la recherche de nourriture (énergie de déplacement). La tenue d’un territoire demanderait, vue la grandeur de celui-ci, une dépense énergétique beaucoup trop importante. Par ailleurs, la qualité de l’habitat limitant sérieusement l’augmentation de la densité de population, le nombre d’"adversaires" potentiels serait de toute façon restreint. On peut imaginer qu’il est plus profitable, lorsque certaines ressources sont disponibles en grande quantité dans le domaine vital, de tolérer la présence de congénères, puis de pouvoir aller se nourrir dans les domaines voisins, lorsque la nourriture y est à son tour abondante. Les domaines vitaux des animaux devraient donc s’entrecouper suivant les périodes de l’année.
Synthèse et autres prédictions de la HSEC
Le Tab. 2 présente un aperçu global des prédictions de la HSEC pour un habitat optimal d’un côté, et pour un habitat suboptimal de l’autre. La présence de blaireaux vivant dans des habitats suboptimaux doit être assez rare, vu le peu d’endroits ou ceux-ci vivent de façon solitaire et non territoriale (dans un habitat suboptimal; certains, nous l’avons vu, peuvent vivrent de cette façon lors de la phase de colonisation d’un habitat optimal). La plupart des habitats semblent donc être optimaux, mais leur degré de qualité varie considérablement, comme l’indique la grande variabilité du nombre d’individus composants les groupes spatiaux.
Les prédictions pour l’"habitat optimal" ne sont applicables qu’uniquement à des populations en état d’équilibre, c’est-à-dire aux endroits ou la densité maximale de population est atteinte. Certains habitats peuvent donc paraître très favorables au premier abord, mais tant que certains facteurs déstabilisants opèrent (chasse, gazages, mortalité dû au traffic routier,...), la "faible" densité des populations entraînera toujours une dépense énergétique per capita en dessous du seuil critique déclenchant le passage d’un système non territorial à un système territorial. Ceci explique que dans la plupart des régions d’Europe centrale le Blaireau vit presque toujours en couple ou en petits groupes spatiaux non territoriaux, vu la pression constante exercée par la circulation routière, et, dans certaines régions, par la chasse. En revanche, dans plusieurs régions d’Angleterre ou d’Irlande (où l’animal est protégé), la densité des populations est souvent maximale et les blaireaux vivent en groupes territoriaux, le nombre d’individus qu’ils contiennent dépendant largement du type et de la qualité de l’habitat (dans tous les cas optimaux).
Ailleurs en Europe, où le blaireau est également protégé et où les autres pressions sont absentes, la possibilité que les blaireaux mènent une vie territoriale est très grande. Ainsi, comme nous l’avons vu, dans le Parc Naturel de Maremma, en Italie, ou dans le Parc National de Doñana, en Espagne, les blaireaux possèdent des territoires individuels ou de couple, respectivement. La présence d’aussi peu d’invidus par territoire, dans une région décrite comme "favorable" au point de vue alimentaire, mais où la capacité maximale semble assez basse, pourrait s’expliquer par le fait que la dépense énergétique par individu ait atteint rapidement un seuil critique lors de la période de colonisation (autrement dit l’intensité de la compétition intraspécifique dans le système non territorial aurait atteint son maximum avec quelques individus seulement).
Tab. 3 :
Les deux phases explicatives de la HSEC.|
Caractères |
Habitat optimal |
Habitat suboptimal |
|
Hypothèse (HSEC) |
¯ |
¯ |
|
Bilan alimentaire et énergétique par rapport à la formation d’un groupe |
Favorable |
Défavorable |
|
Hypothèse (HSEC) |
¯ |
¯ |
|
Territoire / domaine vital (colonisation) |
Domaine vital |
Domaine vital |
|
Territoire / domaine vital (à l’équilibre) |
Territoire |
Domaine vital |
|
Raisons de la territorialité lors de l’augmentation de densité des animaux |
Baisse de l’énergie totale à dépenser |
La défense d’un territoire exige trop d’énergie |
|
Hypothèse (HSEC) |
¯ |
¯ |
|
Facteurs principaux déterminant la dimension et l’allure du territoire respectivement du domaine vital de base |
Structure de l’habitat, compétition, facteurs déstabilisants, besoins vitaux et rendement de l’animal |
La répartition des parcelles alimentaires joue un rôle prépondérant |
|
Facteurs principaux déterminant l’effectif du groupe |
Richesse des parcelles alimentaires |
Bilan énergétique défavorable à la constitution d’un groupe |
|
Hypothèse (HSEC) |
¯ |
¯ |
|
Structure sociale |
Vie en groupe spatiaux (clans) de 2 à plusieurs individus Exceptionnellement vie solitaire territoriale |
Vie solitaire (rencontre mâle-femelle limitée uniquement à la période de reproduction) ou mère avec jeunes |
|
Dispersion des jeunes |
Uniquement lorsqu’aucun des membres du groupe n’a péri ou émigré ou lorsque la quantité de nourriture sur le territoire n'augmente pas |
En septembre de la première année |
|
Mortalité des jeunes |
Faible vu le milieu favorable et l’assu-rance de vivre au sein d’un groupe |
Haute vu le milieu défavorable et la nécessité de trouver un nouvel habitat |
|
Utilisation des terriers |
Les terriers princi-paux sont utilisés continuellement |
Changement fréquent des terriers afin d’ac-céder à une nourriture très dispersée et tem-porairement variable |
|
Précision de la connaissance des domaines vitaux par l’animal |
Très précise vue la petite taille du territoire |
Peu précise vue la grandeur du territoire et la variabilité des ressources alimentaires |
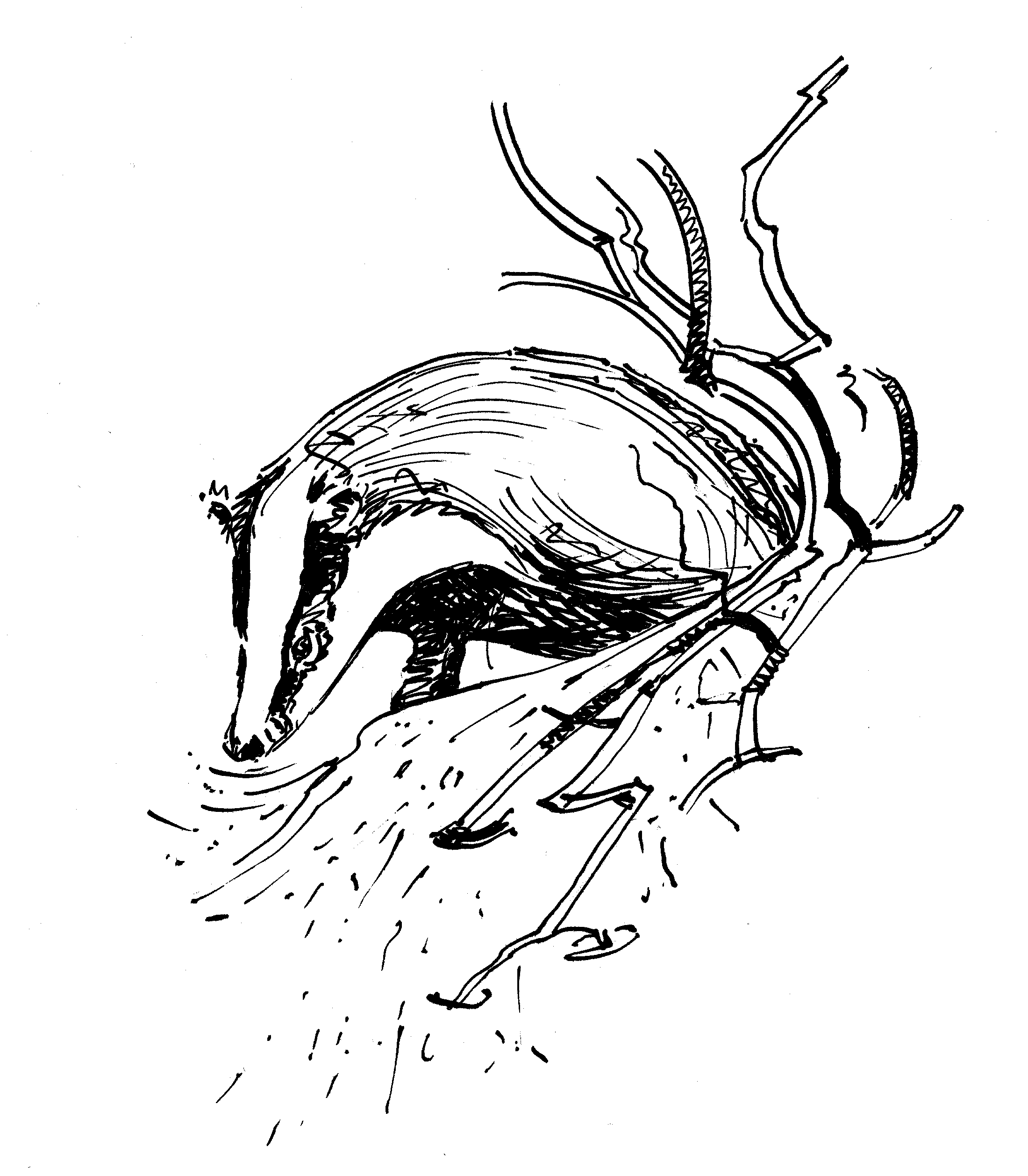

© Georges Veya, 1996
Tab. 15 :
Liste der erfassten Habitatparameter für die Baue und Latrinen mit Angabe der Klasseneinteilung, des Skalen-Typs, der Erfassungsmethode und der Abkürzung für die jeweilige Variable.|
N° |
Parameter |
Klassen |
Skala |
Erfassung |
Variable |
|
A |
Bau-/Latrinen-Merkmale |
|
|
|
|
|
1 |
Aktivität Fuchs / Dachs / Andere |
11, 10, 01, 00 |
Nominal |
Feld |
AKT |
|
2 |
Nutzung |
0-2 |
Ordinal |
Feld |
BN / LN |
|
3 |
Anzahl Röhren / Gruben |
x |
Verhältnis |
Feld |
AR / AG |
|
4 |
Anzahl benutzte Röhren / Gruben |
x |
Verhältnis |
Feld |
ABR / ABG |
|
5/6 |
Ausdehnung Länge / Breite |
m |
Verhältnis |
Feld |
AL / AB |
|
B |
Geographie / Topographie |
|
|
|
|
|
7 |
X-Koordinaten |
m |
Verhältnis |
GIS |
X |
|
8 |
Y-Koordinaten |
m |
Verhältnis |
GIS |
Y |
|
9 |
Höhe ü. M. |
m |
Verhältnis |
Karte |
ALT |
|
10 |
Exposition |
1-9 |
Nominal |
Feld |
EXP |
|
11 |
Hangneigung |
1-6 |
Ordinal |
Feld |
PEN |
|
12 |
Relief |
1-6 |
Nominal |
Feld |
REL |
|
C |
Geologie / Pedologie |
|
|
|
|
|
13 |
Bodentyp |
¾ |
Nominal |
Bodenkarte |
BOT |
|
14 |
Bodengründigkeit |
1-5 |
Ordinal |
Literatur |
BOG |
|
15 |
Bodenkörnung |
0-9 |
Nominal |
Literatur |
BOK |
|
16 |
Skelettgehalt |
1-5 |
Ordinal |
Literatur |
SKG |
|
17 |
Bodendurchlässigkeit |
1-6 |
Ordinal |
Literatur |
BOD |
|
18 |
Bodenvernässung |
1-6 |
Ordinal |
Literatur |
BOV |
|
D |
Habitat / Vegetation |
|
|
|
|
|
19 |
Habitattyp |
0-9 |
Nominal |
Feld |
HT |
|
20 |
Entwicklungsstufe |
0-9 |
Ordinal |
Feld |
EST |
|
21 |
Mischungsgrad |
1-4 |
Ordinal |
Feld |
COMP |
|
22 |
Hauptbaumart |
0-9 |
Nominal |
Feld |
HBA |
|
23 |
Deckungsgrad Baumschicht |
0-5 |
Ordinal |
Feld |
DGB |
|
24 |
Deckungsgrad Strauchschicht |
0-5 |
Ordinal |
Feld |
DGS |
|
25 |
Deckungsgrad Krautschicht |
0-5 |
Ordinal |
Feld |
DGK |
|
26 |
Deckungsgrad Moosschicht |
0-5 |
Ordinal |
Feld |
DGM |
|
E |
"Ökologische" Lage |
|
|
|
|
|
27 |
Distanz zum Waldrand |
1-5 |
Ordinal |
GIS / Feld |
DWR |
|
28 |
Distanz zum nächsten Weg |
1-5 |
Ordinal |
GIS / Feld |
DWG |
|
29 |
Distanz zur nächsten Strasse |
1-5 |
Ordinal |
GIS / Feld |
DS |
|
30 |
Distanz zum nächsten Wasserlauf |
1-5 |
Ordinal |
GIS / Feld |
DWL |
|
31 |
Distanz zum nächsten Bau |
1-6 |
Ordinal |
GIS / Feld |
DB |
|
32 |
Distanz zum nächsten Maisfeld |
1-6 |
Ordinal |
GIS |
DM |
|
33 |
Distanz zum nächsten Weizenfeld |
1-6 |
Ordinal |
GIS |
DWZ |
|
34 |
Distanz zum nächsten Gerstenfeld |
1-6 |
Ordinal |
GIS |
DG |
|
35 |
Distanz zum nächsten Haferfeld |
1-6 |
Ordinal |
GIS |
DH |
|
36 |
Distanz zum nächsten Obstfeld |
1-6 |
Ordinal |
GIS |
DO |
|
37 |
Distanz zur nächsten Wiese (Juni) |
1-6 |
Ordinal |
GIS |
DWN |
|
38 |
Distanz zur nächsten Wiese (Juli) |
1-6 |
Ordinal |
GIS |
DWJ |
|
39 |
Distanz zur nächsten Wiese (August) |
1-6 |
Ordinal |
GIS |
DWA |
Tab. 16 :
Liste der erfassten Habitatparameter für die Baue und Latrinen mit Beschreibung der entsprechenden Klassen und Wertebereiche.|
N° |
Variable |
Klasseneinteilung und Wertebereiche |
|
A |
|
Bau- und Latrinen-Merkmale |
|
1 |
AKT |
11 =Dachs + Fuchs, 10=Dachs, 01=Fuchs, 00=Andere |
|
2 |
BN / LN |
0 =nicht benutzt, 1=benutzt, 2=stark benutzt |
|
3 |
AR / AG |
x / x (kontinuierlich) |
|
4 |
ABR / ABG |
x / x (kontinuierlich) |
|
5/6 |
AL / AB |
m / m (kontinuierlich) |
|
B |
|
Geographie / Topographie |
|
7/8 |
X / Y |
m (kontinuierlich) |
|
9 |
ALT |
m (kontinuierlich) |
|
10 |
EXP |
1 =N, 2=NE, 3=E, 4=SE, 5=S, 6=SW, 7=W, 8=NW, 9=Krete |
|
11 |
PEN |
1 =0-10%, 2=11-20%, 3=21-30%, 4=31-40%, 5=41-50%, 6: >50% |
|
12 |
REL |
1 =Ebene, 2=flacher Hang, 3=konkaver Hang,4=konvexer Hang, 5=Mulde, 6=Kuppe, Krete |
|
C |
|
Geologie / Pedologie |
|
13 |
BOT |
verschiedene Typen |
|
14 |
BOG |
1 =sehr tief (> 120 cm), 2=tief (90-120 cm), 3=mittel (60-90 cm),4=flach (30-60 cm), 5=sehr flach (< 30 cm) |
|
15 |
BOK |
0 =Sand, 1=lehmiger Sand, 2=sandiger Lehm, 3=schwach sandiger Lehm, 4=Schluff, 5=Schlufflehm, 6=toniger Schlufflehm, 7=schwach toniger Lehm, 8=toniger Lehm 9=Ton |
|
16 |
SKG |
1 =skelettfrei (0-4%), 2=skelettarm (5-10%), 3=skeletthaltig (10-20%), 4=skelettreich (20-50%), 5=extrem skelettreich (> 50%) |
|
17 |
BOD |
1 =übermässig (> 10-2 cm/sec), 2=normal (> 10-3 cm/sec),3=schwach gehemmt (> 10-4 cm/sec), 4=gehemmt (> 10-5 cm/sec), 5=stark gehemmt (> 10-6 cm/sec), 6=undurchlässig (<10-6 cm/sec) |
|
18 |
BOV |
1 =keine, 2=grundfeucht (> 90 cm), 3=schwach grundnass (60-90 cm),4=mässig grundnass (45-60 cm), 5=ziemlich stark grundnass (30-45 cm), 6=stark grundnass (< 30 cm) |
|
D |
|
Habitat / Vegetation |
|
19 |
HT |
0 =Laub-/Mischwald, 1=Nadelwald, 2=Böschung/Hecke, 3=Dickicht, 4=Offenes Feld, 5=Steinbruch, 6=Felswand, 7=Heide/Moor, 8=Vorstädtische Zone, 9=Divers |
|
20 |
EST |
0 =stufig/Mosaik, 1=0-20 Jahre, 2=20-40 Jahre, 3=40-60 Jahre, 4=60-80 Jahre,5=80-100 Jahre, 6=100-120 Jahre, 7: >120 Jahre, 8=..., 9=ehemalige Mittelwälder |
|
21 |
COMP |
1 =NH 91-100%, 2=NH 51-90%, 3=LH 51-90%, 4=LH 91-100% |
|
22 |
HBA |
0 =Rottanne, 1=Weisstanne, 2=Föhre, 3=Lärche, 4=übriges NH,5=Buche, 6=Eiche, 7=Esche, 8=Ahorn, 9=übriges LH |
|
23 |
DGB |
0 =keine, 1=bis 5%, 2=6-25%, 3=26-50%, 4=51-75%, 5: >75% |
|
24 |
DGS |
0 =keine, 1=bis 5%, 2=6-25%, 3=26-50%, 4=51-75%, 5: >75% |
|
25 |
DGK |
0 =keine, 1=bis 5%, 2=6-25%, 3=26-50%, 4=51-75%, 5: >75% |
|
26 |
DGM |
0 =keine, 1=bis 5%, 2=6-25%, 3=26-50%, 4=51-75%, 5: >75% |
|
E |
|
"Ökologische" Lage |
|
27 |
DWR, |
1: £ 10 m, 2: £ 50 m, 3: £ 100 m, 4: £ 250 m, 5: > 250 m |
|
bis |
DWG, DS, |
1: £ 10 m, 2: £ 50 m, 3: £ 100 m, 4: £ 250 m, 5: > 250 m |
|
30 |
DWL |
1: £ 10 m, 2: £ 50 m, 3: £ 100 m, 4: £ 250 m, 5: > 250 m |
|
31 |
DB, DM, DWZ, |
1: £ 50 m, 2: £ 100 m, 3: £ 150 m, 4: £ 200 m, 5: £ 250 m, 6: > 250 m |
|
bis |
DG, DH, DO, |
1: £ 50 m, 2: £ 100 m, 3: £ 150 m, 4: £ 200 m, 5: £ 250 m, 6: > 250 m |
|
39 |
DWN, DWJ, DWA |
1: £ 50 m, 2: £ 100 m, 3: £ 150 m, 4: £ 200 m, 5: £ 250 m, 6: > 250 m |
Tab. 17 :
Protokollblatt für die Feldaufnahmen.|
Protokoll Spuren & Habitatparameter |
||||
|
Bauname : ........................................ Datum : .................... Latrinennummer : ............. Uhrzeit : ................... |
||||
|
N° |
Variable |
Klassifizierung |
Wert |
Bemerkung |
|
1 |
AKT |
11 = Dachs + Fuchs 10 = Dachs 01 = Fuchs 00 = andere |
|
|
|
2 |
BN / LN |
0 = nicht benutzt 1 = benutzt 2 = stark benutzt (ausgetreten) |
|
|
|
3 |
AR / AG |
x / x |
|
|
|
4 |
ABR / ABG |
x / x |
|
|
|
5/6 |
AL / AB |
m / m |
|
|
|
|
|
|
|
|
|
10 |
EXP |
1 = N 2 = NE 3 = E 4 = SE 5 = S 6 = SW 7 = W 8 = NW 9 = Krete |
|
|
|
11 |
PEN |
1 = 0-20 % 2 = 21-40 % 3 = 41-60 % 4 = 61-80 % 5 = 81-100 % 6 = > 100 % |
|
|
|
12 |
REL |
1 = Ebene 2 = flacher Hang 3 = konk. Hang 4 = konv. Hang 5 = Mulde 6 = Kuppe, Krete |
|
|
|
|
|
|
|
|
|
15 |
HT |
0=Laub-/Mischwald 1=Nadelwald 2=Böschung/Hecke 3=Dickicht 4=Offenes Feld 5=Steinbruch 6=Felswand 7=Heide/Moor 8=Vorstädtische Zone 9=Divers |
|
|
|
16 |
EST |
0 = stufig/Mosaik 1 = 0-20 Jahre 2 = 20-40 Jahre 3 = 40-60 Jahre 4 = 60-80 Jahre 5 = 80-100 Jahre 6 = 100-120 Jahre 7 = > 120 Jahre 8 = ...... 9 = ehemalige Mittelwälder |
|
400 m2 |
|
17 |
COMP |
1 = NH 90-100 % 2 = NH 50-90 % 3 = LH 50-90 % 4 = LH 90-100 % |
|
400 m2 |
|
18 |
HBA |
0 = Rottanne 1 = Weisstanne 2 = Föhre 3 = Lärche 4 = übriges NH 5 = Buche 6 = Eiche 7 = Esche 8 = Ahorn 9 = übriges LH |
|
400 m2 |
|
19 |
DGB |
0 = keine 1 = bis 5 % 2 = 6-25 % 3 = 26-50 % 4 = 51-75 % 5 = > 75 % |
|
400 m2 |
|
20 |
DGS |
0-5 siehe DGB |
|
100 m2 |
|
21 |
DGK |
0-5 siehe DGB |
|
100 m2 |
|
22 |
DGM |
0-5 siehe DGB |
|
5 x 1 m2 |
|
|
|
|
|
|
|
23 |
DWR |
m |
|
|
|
24 |
DWG |
m |
|
|
|
25 |
DS |
m |
|
|
|
26 |
DWL |
m |
|
|
|
27 |
DB |
m |
|
|
Tab. 18 :
Originaldaten der Habitatparameter für die gefundenen Baue. Teil 1.
Tab. 19 :
Originaldaten der Habitatparameter für die gefundenen Baue. Teil 2.
Tab. 20 :
Originaldaten der Habitatparameter für die gefundenen Latrinen. Teile 1 & 2.
Tab. 21 :
Zusammenstellung der Resultate der 2 multiplen logistischen bzw. der 4 multiplen linearen Regressionen der unabhängigen "Dachs- bzw. Fuchsvariablen" (= Zielgrössen, d. h. Y1 und Y2 bzw. Y3 bis Y6) mit den 4 durch die Hauptkomponenten-Analyse generierten Habitatfaktoren (abhängige oder erklärende Variablen). Die Schätzungen für die Koeffizienten des Modelles Yi = a + b 1x1 + b 2x2 + b 3x3 + b 4x4 + Ei (Ei = Fehler) sind in der Reihe "B" aufgeführt. Die Habitatfaktoren, die in den jeweiligen Regressionsgleichungen erscheinen, sind mit der Buchstabe "G" (für Gleichung) gekennzeichnet. Die Nullhypothese Ho : b i = 0 wurde jedoch nie verworfen, d. h. die einzelnen Koeffizienten b i sind nicht signifikant von 0 verschieden. Die entsprechenden P-Werte sind jeweils angegeben.|
N° |
Habitatfaktoren |
B |
P-Wert |
|
1 |
Y1 = Aktivität Fuchs |
|
|
|
G |
Konstante |
1.0678 |
0.0022 |
|
¾ |
x1 = "Feuchtigkeit" |
1.3100 |
0.2524 |
|
¾ |
x2 = Boden |
0.2341 |
0.6285 |
|
¾ |
x3 = Deckungsgrad |
0.2336 |
0.6289 |
|
¾ |
x4 = Entwicklungsstufe |
0.3234 |
0.5996 |
|
2 |
Y2 = Aktivität Dachs |
|
|
|
G |
Konstante |
- 0.2336 |
0.4468 |
|
¾ |
x1 = "Feuchtigkeit" |
0.4389 |
0.5077 |
|
¾ |
x2 = Boden |
0.9375 |
0.3329 |
|
¾ |
x3 = Deckungsgrad |
2.2779 |
0.1312 |
|
¾ |
x4 = Entwicklungsstufe |
0.9220 |
0.3370 |
|
3 |
Y3 = Anzahl Röhren |
|
|
|
¾ |
Konstante |
¾ |
¾ |
|
¾ |
x1 = "Feuchtigkeit" |
- 0.0567 |
0.7179 |
|
¾ |
x2 = Boden |
- 0.0455 |
0.7722 |
|
¾ |
x3 = Deckungsgrad |
- 0.0393 |
0.8022 |
|
¾ |
x4 = Entwicklungsstufe |
- 0.0113 |
0.9428 |
|
4 |
Y4 = Anzahl benutzte Röhren |
|
|
|
G |
Konstante |
2.6977 |
0.0000 |
|
G |
x1 = "Feuchtigkeit" |
0.1384 |
0.8106 |
|
G |
x2 = Boden |
- 0.4313 |
0.4566 |
|
G |
x3 = Deckungsgrad |
- 0.1950 |
0.7356 |
|
G |
x4 = Entwicklungsstufe |
- 0.3807 |
0.5107 |
|
5 |
Y5 = Ausdehnung Länge |
|
|
|
G |
Konstante |
2.6977 |
0.0000 |
|
¾ |
x1 = "Feuchtigkeit" |
0.0386 |
0.8106 |
|
G |
x2 = Boden |
- 0.4313 |
0.4510 |
|
G |
x3 = Deckungsgrad |
- 0.1950 |
0.7325 |
|
G |
x4 = Entwicklungsstufe |
- 0.3807 |
0.5055 |
|
6 |
Y6 = Ausdehnung Breite |
|
|
|
G |
Konstante |
2.6977 |
0.0000 |
|
¾ |
x1 = "Feuchtigkeit" |
0.0386 |
0.8084 |
|
G |
x2 = Boden |
- 0.4313 |
0.4459 |
|
¾ |
x3 = Deckungsgrad |
- 0.0543 |
0.7325 |
|
G |
x4 = Entwicklungsstufe |
- 0.3807 |
0.5006 |
Tab. 22 :
Ressourcen-Angebot um die Baue (Flächen in m2). Stand : Mitte Juni 1997.
[Hier kommt die Tabelle aus der Datei "166juni.doc".]
Tab. 23 :
Ressourcen-Angebot um die Baue (Flächen in m2). Stand : Mitte Juli 1997.
[Hier kommt die Tabelle aus der Datei "166juli.doc".]
Tab. 24 :
Ressourcen-Angebot um die Baue (Flächen in m2). Stand : Mitte August 1997.
[Hier kommt die Tabelle aus der Datei "166aug.doc".]
Tab. 25 :
Liste der an verschiedenen Bauen durchgeführten Nachtbeobachtungen.|
# Junge |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
1 |
0 |
|
# Adulte |
0 |
0 |
0 |
1 |
1 |
2 |
1 |
1 |
1 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
2 |
1 |
1 |
0 |
1 |
0 |
1 |
1 |
|
# Tiere |
0 |
0 |
0 |
1 |
1 |
3 |
1 |
1 |
1 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
2 |
1 |
1 |
0 |
2 |
0 |
2 |
1 |
|
Wetter |
bewölkt, viel Wind |
schön |
schön |
schön |
schön |
schön |
schön |
bewölkt (Regen a. T.) |
Gewitter |
bewölkt |
Wind und Regen |
sehr schön |
schön |
sehr schön |
sehr schön |
bewölkt (Regen a. T.) |
schön, leicht bewölkt |
sehr schön |
bewölkt, dann Regen |
schön |
sehr schön |
heiss, gewitterhaft |
schön |
schön |
Regen |
|
Dauer |
1h45 |
1h30 |
1h30 |
1h45 |
0h45 |
2h15 |
2h00 |
1h20 |
1h50 |
1h40 |
1h00 |
1h30 |
1h30 |
1h35 |
1h30 |
1h30 |
1h30 |
1h20 |
1h20 |
1h20 |
1h20 |
2h00 |
1h30 |
1h30 |
1h20 |
|
Zeit |
20h45 – 22h30 |
21h00 – 22h30 |
21h00 – 22h30 |
20h45 – 22h30 |
21h00 – 21h45 |
20h45 – 23h00 |
21h00 – 23h00 |
21h10 – 22h30 |
21h10 – 23h00 |
20h50 – 22h30 |
21h00 – 22h00 |
21h00 – 22h30 |
21h00 – 22h30 |
20h45 – 22h20 |
21h00 – 22h30 |
21h00 – 22h30 |
21h00 – 22h30 |
21h10 – 22h30 |
21h10 – 22h30 |
21h10 – 22h30 |
21h00 – 22h20 |
20h30 – 22h30 |
21h00 – 22h30 |
21h00 – 22h30 |
20h40 – 22h00 |
|
Bauname |
Rorholz |
Rorholz |
Rorholz |
Wolfacherhölzli 1 |
Wolfacherhölzli 1 |
Brüggen 1 |
Brüggen 1 |
Wolfacherhölzli 1 |
Brüggen 1 |
Brüggen 1 |
Hinter Jungalbis 1 |
Seleger Moor 1 |
Hinter Jungalbis 1 |
Hinter Jungalbis 1 |
Brüggen 1 |
Brüggen 1 |
Brüggen 1 |
Rorholz |
Rorholz |
Rorholz |
Hinter Jungalbis 1 |
Seeholz 1 |
Seeholz 1 |
Seeholz 1 |
Seleger Moor 1 |
|
Datum |
21.05.97 |
27.05.97 |
28.05.97 |
04.06.97 |
05.06.97 |
09.06.97 |
10.06.97 |
12.06.97 |
17.06.97 |
20.06.97 |
24.06.97 |
08.07.97 |
11.07.97 |
12.07.97 |
13.07.97 |
14.07.97 |
15.07.97 |
16.07.96 |
17.07.96 |
21.07.97 |
22.07.97 |
23.07.97 |
28.07.97 |
29.07.97 |
02.08.97 |
|
N° |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |